题目内容
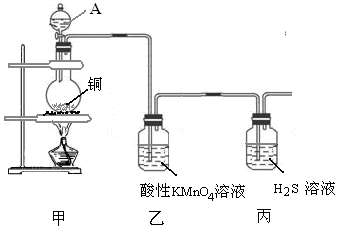
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4 g铜片和含0.2 moL溶质的18.4 mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止。(假定在此过程溶液体积不变)
(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:________________
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:_____
| A.铁粉 | B.钠 | C.氯化钡溶液 | D.银粉 |
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度。他设计了如下二种方案来测定SO2的量:
方案① 将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
方案② 将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀。
经仔细分析后,发现有不合理之处,请填写下表(可以不填满):
| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | | | |
| 方案② | | | |
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000 mL,取20.00 mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是_______________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)_____________________________________________________。
(1)无必要,随着反应的进行,浓硫酸变成稀硫酸,稀硫酸与铜不反应。 (2)A
(3)I方案序号 不合理的原因 误差(偏低或偏高) 改变措施 方案① 高锰酸钾溶液中含有硫酸,与氯化钡反应,使生成的沉淀增多 偏低 将硫酸酸化的高锰酸钾溶液换成溴水或碘水或硝酸溶液 方案② -- -- --
Ⅱ.不能,PH>5时,Cu2+会与碱反应生成沉淀,不能达到滴定终点。
(4)方案一:①取反应后溶液,向其中加入足量锌;②收集并测定氢气的体积;③通过氢气量计算剩余硫酸的物质的量浓度
方案二:反应结束后将烧瓶中的铜片取出,洗净、烘干,称其质量即可
方案三:反应结束后将烧瓶中的铜片取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量。
解析试题分析:(1)开始是能硫酸与Cu发生反应:Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O。随着反应的进行。硫酸逐渐变稀。稀硫酸与铜片不发生反应。反应后的溶液中含有CuSO4、H2O及过量的H2SO4。要证明反应结束后的烧瓶中确有余酸,A.加入Fe粉会发生反应:CuSO4+Fe= FeSO4+Cu; H2SO4+Fe= FeSO4+H2↑.会有气体产生,因此会冒出气泡。正确。B.由于溶液中含有大量的水,无论酸是否有剩余,都会发生反应:2Na+2H2O=2NaOH+H2↑。因此不能证明酸剩余。错误。C.溶液中含有CuSO4,一定会发生反应:Ba2++SO42-=BaSO4↓。不能证明酸剩余。错误。D.在金属活动性顺序表中Ag位于H后面,不能把酸中的氢置换出来。错误。因此选项为A。(3)I、方案①中KMnO4溶液酸化是用的硫酸,因此在高锰酸钾溶液中的SO42-包括SO2氧化产生的和外加的两部分,这样产生的硫酸钡沉淀就偏多,导致剩余的硫酸偏少(或偏低)。改变的措施是采用其它的氧化剂如溴水或碘水或硝酸溶液等氧化SO2,使其转化为硫酸,再用氯化钡溶液减小滴定。方案②设计合理、操作无误。Ⅱ、用标准NaOH溶液滴定剩余硫酸时,由于在溶液中含有CuSO4,用酚酞作指示剂,变色点为8,但氢氧化铜开始沉淀的pH约为5。Cu2+也会与碱反应生成沉淀,不能达到滴定终点。无法准确测定剩余硫酸的物质的量的多少。(4)其他可行的用来测定余酸的物质的量浓度实验方案可以是方案一:①取反应后溶液,向其中加入足量锌;②收集并测定氢气的体积;③通过H2量计算剩余硫酸的物质的量浓度。方案二:反应结束后将烧瓶中的铜片取出,洗净、在N2的环境中烘干,称其质量即可。方案三:反应结束后将烧瓶中的铜片取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量。根据反应消耗的Cu的质量科确定由CuSO4产生的沉淀的质量。进而计算出剩余酸的物质的量。在这三种方案中第三种方案可操作性更强,误差更小。第二种方法中要在惰性气体或N2的环境中进行不容易进行。而第一种方法H2的体积测量容易引起误差,而且不容易换算为标准状况下。容易产生误差。
CuSO4+SO2↑+2H2O。随着反应的进行。硫酸逐渐变稀。稀硫酸与铜片不发生反应。反应后的溶液中含有CuSO4、H2O及过量的H2SO4。要证明反应结束后的烧瓶中确有余酸,A.加入Fe粉会发生反应:CuSO4+Fe= FeSO4+Cu; H2SO4+Fe= FeSO4+H2↑.会有气体产生,因此会冒出气泡。正确。B.由于溶液中含有大量的水,无论酸是否有剩余,都会发生反应:2Na+2H2O=2NaOH+H2↑。因此不能证明酸剩余。错误。C.溶液中含有CuSO4,一定会发生反应:Ba2++SO42-=BaSO4↓。不能证明酸剩余。错误。D.在金属活动性顺序表中Ag位于H后面,不能把酸中的氢置换出来。错误。因此选项为A。(3)I、方案①中KMnO4溶液酸化是用的硫酸,因此在高锰酸钾溶液中的SO42-包括SO2氧化产生的和外加的两部分,这样产生的硫酸钡沉淀就偏多,导致剩余的硫酸偏少(或偏低)。改变的措施是采用其它的氧化剂如溴水或碘水或硝酸溶液等氧化SO2,使其转化为硫酸,再用氯化钡溶液减小滴定。方案②设计合理、操作无误。Ⅱ、用标准NaOH溶液滴定剩余硫酸时,由于在溶液中含有CuSO4,用酚酞作指示剂,变色点为8,但氢氧化铜开始沉淀的pH约为5。Cu2+也会与碱反应生成沉淀,不能达到滴定终点。无法准确测定剩余硫酸的物质的量的多少。(4)其他可行的用来测定余酸的物质的量浓度实验方案可以是方案一:①取反应后溶液,向其中加入足量锌;②收集并测定氢气的体积;③通过H2量计算剩余硫酸的物质的量浓度。方案二:反应结束后将烧瓶中的铜片取出,洗净、在N2的环境中烘干,称其质量即可。方案三:反应结束后将烧瓶中的铜片取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量。根据反应消耗的Cu的质量科确定由CuSO4产生的沉淀的质量。进而计算出剩余酸的物质的量。在这三种方案中第三种方案可操作性更强,误差更小。第二种方法中要在惰性气体或N2的环境中进行不容易进行。而第一种方法H2的体积测量容易引起误差,而且不容易换算为标准状况下。容易产生误差。
考点:考查实验方案的设计与评价及误差分析的知识。

某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
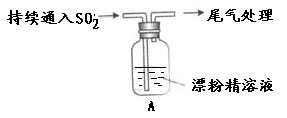 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式 ;
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是 ;
②由实验a、b不能判断白雾中含有HC1,理由是 ;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 ;
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- ="=" 3C1-+ IO3-
IO3- + 5I-+ 3H2O ="=" 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为 。
某学习兴趣小组探究氨气的制取实验:
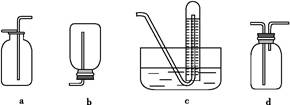
(1)甲同学拟用下列实验方法制备氨气,其中合理的是 (填序号,下同)。
| A.将氯化铵固体加热分解 |
| B.将浓氨水滴入氢氧化钠固体中 |
| C.将氢氧化钠固体加入浓氨水中 |
| D.将氯化铵稀溶液滴入氢氧化钠固体中 |
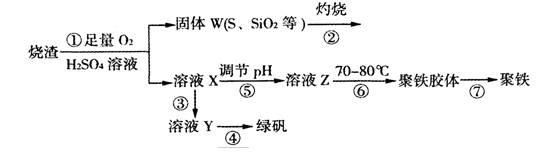
 SiHCl3+H2
SiHCl3+H2
 NaNO3+NaNO2+H2O
NaNO3+NaNO2+H2O

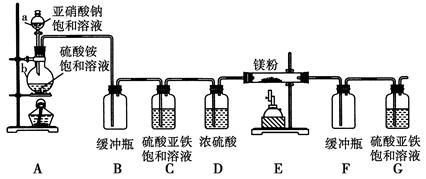
 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。