摘要:14.右图所示外界条件变化对下列反应的影响 X(s) + M; △H>0,图中 y轴指的是 ( ) A.平衡混合气中的N的百分含量 B.平衡混合气中M的百分含量 C.M的转化率 D.X的转化率
网址:http://m.1010jiajiao.com/timu3_id_358282[举报]
 ( 08鄞州中学限时训)A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件未标出)。
( 08鄞州中学限时训)A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件未标出)。
(1) 若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,③与④两个反应中都有红棕色气体生成,则A的原子结构示意图为__________;反应①的化学方程式是_________。
反应④的化学方程式是 。
(2) 若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则B固体属于 晶体,E固体与B固体比较______熔点高(填“B”或“E”);反应①的化学方程式是 ;此时固体B与(1)中的B的钠盐高温时反应的化学方程式是______________。
查看习题详情和答案>> (1)一个确定的化学反应完成后的结果是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小.若反应物的总能量
(1)一个确定的化学反应完成后的结果是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小.若反应物的总能量>
>
(填“>”、“<”、“=”)生成物的总能量,该反应就放出能量;若反应物的总能量<
<
生成物的总能量,该反应就吸收能量.(2)普通锌锰酸性干电池的内部结构如右图所示,请回答
①该电池的负极材料为
Zn
Zn
该电极反应为Zn-2e-=Zn2+
Zn-2e-=Zn2+
②正极材料为
石墨(或碳棒)
石墨(或碳棒)
,正极得到电子的氧化剂为MnO2
MnO2
③电解质为
糊状NH4Cl
糊状NH4Cl
(3)化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示.若时间用秒表示,则化学反应速率的单位是
mol?L-1?s-1
mol?L-1?s-1
.(4)在外界条件不变的情况下,一个可逆反应达到的最大限度是该反应达到
化学平衡
化学平衡
状态.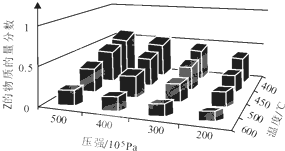 为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如右图所示.以下判断正确的是( )
为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如右图所示.以下判断正确的是( )| A、△H>0,a+b>c | B、△H>0,a+b<c | C、△H<0,a+b>c | D、△H<0,a+b<c |
如图1是煤化工产业链的一部分,试运用所学知识,解决下列问题:

(1)已知该产业链中某反应的平衡表达式为:K=
它所对应的化学反应为:
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+CO2(g)?2CO(g),K1 ①
CO(g)+H2O(g)?H2(g)+CO2(g),K2 ②
C(s)+H2O(g)?CO(g)+H2(g),K3 ③
则K1、K2、K3,之间的关系是:
反应①的平衡常数K随温度的升高而
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图2所示.下列说法正确的是
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N2O4、NO2的量),反应速率v与时间t关系如右图所示.图中t4时引起平衡移动的条件可能是
查看习题详情和答案>>

(1)已知该产业链中某反应的平衡表达式为:K=
| [H2][CO] |
| [H2O] |
它所对应的化学反应为:
C(s)+H2O(g)?CO(g)+H2(g)
C(s)+H2O(g)?CO(g)+H2(g)
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+CO2(g)?2CO(g),K1 ①
CO(g)+H2O(g)?H2(g)+CO2(g),K2 ②
C(s)+H2O(g)?CO(g)+H2(g),K3 ③
则K1、K2、K3,之间的关系是:
K3=K1×K2
K3=K1×K2
.反应①的平衡常数K随温度的升高而
增大
增大
(增大/减小/不变).一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | n(C)mol | n(H2O)mol | n(CO)mol | n(H2)mol | v正、v逆比较 |
| Ⅰ | 0.2 | 0.12 | 1.20 | 0.20 | v正=v逆 |
| Ⅱ | 0.16 | 0.20 | 0.40 | 0.80 | v正 > > v逆 |
Q=
=0.8<1=K,Q<K 平衡向正方向进行,所以v正>v逆
| 0.2×0.4 |
| 0.1 |
Q=
=0.8<1=K,Q<K 平衡向正方向进行,所以v正>v逆
| 0.2×0.4 |
| 0.1 |
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图2所示.下列说法正确的是
D
D
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N2O4、NO2的量),反应速率v与时间t关系如右图所示.图中t4时引起平衡移动的条件可能是
增大压强
增大压强
;图中表示平衡混合物中NO2的含量最高的一段时间是t3~t4
t3~t4
.
工业生产硝酸的流程图如下:

请回答下列问题:
(1)写出硝酸在工农业生产中的重要作用 (任写一条).
(2)已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.请回答:
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中tl时引起平衡移动的条件可能是 .
其中表示平衡混合物中NH3的含量最高的一段时间是 .
②温度为T℃时,将2a mol H2和a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则该反应的化学平衡常数的为 .
(3)氨催化氧化的化学方程式为 ,该反应是放热反应,当温度升高时,反应的化学平衡常数K值 (增大、减小、无影响).
(4)今年“两会”后,党和国家更加重视环保.工业上常用纯碱溶液来吸收硝酸厂尾气中的二氧化氮,吸收产物中有亚硝酸钠、硝酸钠和二氧化碳,该化学方程式为 ;还可以利用氢气在催化剂下把氮的氧化物还原为 和水.
查看习题详情和答案>>

请回答下列问题:
(1)写出硝酸在工农业生产中的重要作用

(2)已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.请回答:
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中tl时引起平衡移动的条件可能是
其中表示平衡混合物中NH3的含量最高的一段时间是
②温度为T℃时,将2a mol H2和a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则该反应的化学平衡常数的为
(3)氨催化氧化的化学方程式为
(4)今年“两会”后,党和国家更加重视环保.工业上常用纯碱溶液来吸收硝酸厂尾气中的二氧化氮,吸收产物中有亚硝酸钠、硝酸钠和二氧化碳,该化学方程式为