摘要:5.某温度下.0.02mol/L的盐酸跟 0.01mol/L的氢氧化钡溶液等体积混合后.得到的溶液中下列式于肯定正确的是 ( ) A.pH=7 B.Kw=10-14 C.c(H+)=c(OH-) D.c(H+)>10-7mol/L
网址:http://m.1010jiajiao.com/timu3_id_358248[举报]
某温度下,0.1mol?L-1NaHCO3溶液pH=10,下列判断正确的是( )
| A、c(H+)=10-10mol?L-1 | B、c(Na+)>c(OH-)>c(HCO3-)>c(H+) | C、c(Na+)+c(H+)=c(HCO3-)+c(OH-) | D、c(H2CO3)+c(H+)=c(CO32-)+c(OH-) |
 (2013?广州一模)亚憐酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3.
(2013?广州一模)亚憐酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3.(1)PCl3水解可制取亚磷酸:PCl3+3H2O═H3PO3+
3HCl
3HCl
.(2)H3PO3溶液中存在电离平衡:H3PO3?H++H2PO3-.
①某温度下,0.10mol?L-1 的 H3PO3 溶液 pH=1.6,即溶液中 c(H+)=2.5×10-2 mol?L-1.求该温度下上述电离平衡的平衡常数K,写出计算过程.(H3PO3的第二步电离忽略不计,结果保留两位有效数字.)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH
>
>
7 (填“>”、“=”或“<”).(3)亚磷酸具有强还原性,可使碘水褪色.该反应的化学方程式为
H3PO3+I2+H2O=2HI+H3PO4
H3PO3+I2+H2O=2HI+H3PO4
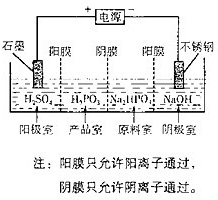
(4)电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:
①阴极的电极反应式为
2H++2e-=H2↑
2H++2e-=H2↑
②产品室中反应的离子方程式为
HPO32-+2H+=H3PO3
HPO32-+2H+=H3PO3
. (2013?济宁二模)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生和Na2HPO3.
(2013?济宁二模)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生和Na2HPO3.(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式
H3PO3+OH-=H2PO3-+H2O
H3PO3+OH-=H2PO3-+H2O
.②某温度下,0.1000mol?L-1的H3PO3溶液pH的读数为1.6,即此时溶液中c (H+)=2.5×10-2mol?L-1,除OH-之外其他离子的浓度由小到大的顺序是
c(HPO32-)<c(H2PO3-)<c(H+)
c(HPO32-)<c(H2PO3-)<c(H+)
,该温度下H3PO3电离平衡的平衡常数K=8.3×10-3mol/L
8.3×10-3mol/L
.(H3PO3第二步电离忽略不计,结果保留两位有效数字)③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中c(Na+)
=
=
c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”).(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式
H3PO3+I2+H2O=2HI+H3PO4
H3PO3+I2+H2O=2HI+H3PO4
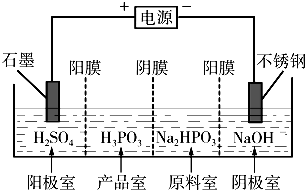
.(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图:说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过
①阴极的电极反应式为
2H++2e-=H2↑
2H++2e-=H2↑
.②产品室中反应的离子方程式为
HPO32-+2H+=H3PO3.
HPO32-+2H+=H3PO3.
.