题目内容
 (2013?广州一模)亚憐酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3.
(2013?广州一模)亚憐酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3.(1)PCl3水解可制取亚磷酸:PCl3+3H2O═H3PO3+
3HCl
3HCl
.(2)H3PO3溶液中存在电离平衡:H3PO3?H++H2PO3-.
①某温度下,0.10mol?L-1 的 H3PO3 溶液 pH=1.6,即溶液中 c(H+)=2.5×10-2 mol?L-1.求该温度下上述电离平衡的平衡常数K,写出计算过程.(H3PO3的第二步电离忽略不计,结果保留两位有效数字.)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH
>
>
7 (填“>”、“=”或“<”).(3)亚磷酸具有强还原性,可使碘水褪色.该反应的化学方程式为
H3PO3+I2+H2O=2HI+H3PO4
H3PO3+I2+H2O=2HI+H3PO4
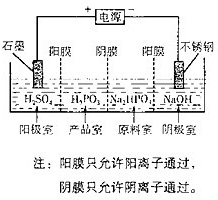
(4)电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:
①阴极的电极反应式为
2H++2e-=H2↑
2H++2e-=H2↑
②产品室中反应的离子方程式为
HPO32-+2H+=H3PO3
HPO32-+2H+=H3PO3
.分析:(1)根据水解反应方程式确定生成物;
(2)①电离平衡常数K=
;
②根据H3PO3的酸性强弱确定Na2HPO3溶液的酸碱性;
(3)亚磷酸和碘发生氧化还原反应,亚磷酸作还原剂被氧化生成磷酸,碘被还原生成氢碘酸,据此写出反应方程式;
(4)①阴极上得电子发生还原反应;
②产品室中HPO32-和氢离子结合 生成亚磷酸.
(2)①电离平衡常数K=
| C(H+).C(H2PO3-) |
| C(H3PO3) |
②根据H3PO3的酸性强弱确定Na2HPO3溶液的酸碱性;
(3)亚磷酸和碘发生氧化还原反应,亚磷酸作还原剂被氧化生成磷酸,碘被还原生成氢碘酸,据此写出反应方程式;
(4)①阴极上得电子发生还原反应;
②产品室中HPO32-和氢离子结合 生成亚磷酸.
解答:解:(1)PCl3水解可制取亚磷酸和盐酸,水解方程式为:PCl3+3H2O?H3PO3+3HCl,故答案为:3HCl;
(2)①H3PO3 ═H++H2PO3-
起始浓度 0.10 0 0
反应浓度 2.5×10-2 2.5×10-2 2.5×10-2
平衡浓度0.10-2.5×10-2 2.5×10-2 2.5×10-2
电离平衡常数K=
=
mol/L=8.3×10-3mol/L,故答案为8.3×10-3mol/L;
②H3PO3是弱酸,Na2HPO3是强碱弱酸盐,所以其水溶液呈碱性,即pH>7,故答案为:>;
(3)亚磷酸和碘发生氧化还原反应,亚磷酸作还原剂被氧化生成磷酸,碘被还原生成氢碘酸,反应方程式为:H3PO3+I2+H2O=2HI+H3PO4,故答案为:H3PO3+I2+H2O=2HI+H3PO4;
(4)①阴极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②产品室中HPO32-和氢离子结合生成亚磷酸,反应离子方程式为:HPO32-+2H+=H3PO3,故答案为:HPO32-+2H+=H3PO3.
(2)①H3PO3 ═H++H2PO3-
起始浓度 0.10 0 0
反应浓度 2.5×10-2 2.5×10-2 2.5×10-2
平衡浓度0.10-2.5×10-2 2.5×10-2 2.5×10-2
电离平衡常数K=
| C(H+).C(H2PO3-) |
| C(H3PO3) |
| 2.5×10-2×2.5×10-2 |
| 0.10-2.5×10-2 |
②H3PO3是弱酸,Na2HPO3是强碱弱酸盐,所以其水溶液呈碱性,即pH>7,故答案为:>;
(3)亚磷酸和碘发生氧化还原反应,亚磷酸作还原剂被氧化生成磷酸,碘被还原生成氢碘酸,反应方程式为:H3PO3+I2+H2O=2HI+H3PO4,故答案为:H3PO3+I2+H2O=2HI+H3PO4;
(4)①阴极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②产品室中HPO32-和氢离子结合生成亚磷酸,反应离子方程式为:HPO32-+2H+=H3PO3,故答案为:HPO32-+2H+=H3PO3.
点评:本题涉及水解反应、氧化还原反应、电极反应式的书写等知识点,电极反应式的书写、有关平衡常数的计算是高考热点,应重点掌握.

练习册系列答案
相关题目
 (2013?广州一模)在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是( )
(2013?广州一模)在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是( )