摘要:20].硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂.实验室通过下列实验由废铁屑制备FeSO4·7H2O晶体: ①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中.加热数分钟.用倾析法除去Na2CO3溶液.然后将废铁屑用水洗涤2-3遍, ②向洗涤过的废铁屑加入过量的稀硫酸.控制温度50-80℃之间至铁屑耗尽, ③趁热过滤.将滤液转入到密闭容器中.静置.冷却结晶, ④待结晶完毕后.滤出晶体.用少量冰水2-3次.再用滤纸将晶体吸干, ⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中.密闭保存. 请回答下列问题: (1)实验步骤①的目的是 .加热的作用是 . (2)实验步骤②明显不合理.理由是 . (3)实验步骤④中用少量冰水洗涤晶体.其目的是 , . (4)经查阅资料后发现.硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O.FeSO4·4H2O和FeSO4·H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃.64℃温度下可同时析出两种晶体). 温度/℃ 0 10 30 50 56.7 60 64 70 80 90 溶解度/g 14.0 17.0 25.0 33.0 35.2 35.3 35.6 33.0 30.5 27.0 析出晶体 FeSO4·7H2O FeSO4·4H2O FeSO4·H2O 请根据表中数据作出硫酸亚铁的溶解度曲线. ⑤若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体.应控制的结晶温度(t)的范围为 .
网址:http://m.1010jiajiao.com/timu3_id_35810[举报]
硫酸亚铁是一种重要的食品和饲料添加剂,某课外兴趣小组在实验室用废铁屑与稀硫酸在加热条件下制取FeSO4?X H2O,并测定该晶体中结晶水含量.请回答下列问题:
(1)铁屑表面少量的铁锈(主要成分为Fe2O3?a H2O )对制取硫酸亚铁有无影响
(2)FeSO4在不同温度下溶解度如下表所示:
由于铁屑中含有C、Si等杂质,为了使FeSO4 溶液的浓度增大,便于反应后分离溶液和残渣.该小组实验时采取了水浴加热和趁热过滤的方法,这样做的主要目的是为了防止
(A)冷却 (B)蒸发
(C)结晶 (D)洗涤 (E)过滤
(3)以下是测定FeSO4?xH2O中结晶水含量的实验流程.(称量仪器为电子天平)
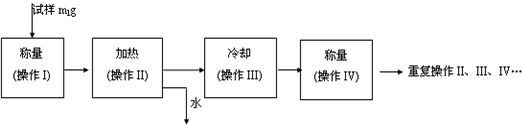
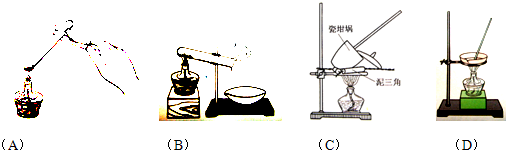
①其加热装置正确的是
②重复操作II、III、IV,直到连续两次称量结果相差不超过
③操作III必须要在
(4)以下结晶水含量测定操作正确的是
A、加热时,晶体溅出坩埚,再加些FeSO4?xH2O
B、加热时,先用小火,后用大火加热至最后
C、加热时,不断用玻璃棒搅拌
D、恒重操作是指加热、冷却、称量这一过程重复两次
(5)实验中出现下列情况时,将对X值有何影响(填“偏大”、“偏小”或“无影响”):灼烧时有黑色固体出现
查看习题详情和答案>>
(1)铁屑表面少量的铁锈(主要成分为Fe2O3?a H2O )对制取硫酸亚铁有无影响
无
无
(填“有”或“无”.其原因是生成的少量Fe3+与铁屑反应转化为Fe2+;
生成的少量Fe3+与铁屑反应转化为Fe2+;
,该步实验的关键是保证铁屑
铁屑
过量(填“硫酸”或“铁屑”);(2)FeSO4在不同温度下溶解度如下表所示:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度/g/100g水 | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
硫酸亚铁晶体析出
硫酸亚铁晶体析出
.你认为实验时的水浴温度最好控制在60
60
℃左右.从滤液中获得FeSO4?xH2O,下列操作中不需要的是B
B
;(A)冷却 (B)蒸发
(C)结晶 (D)洗涤 (E)过滤
(3)以下是测定FeSO4?xH2O中结晶水含量的实验流程.(称量仪器为电子天平)

①其加热装置正确的是
C
C

②重复操作II、III、IV,直到连续两次称量结果相差不超过
0.001
0.001
g;③操作III必须要在
干燥器
干燥器
中(填仪器名称)进行.(4)以下结晶水含量测定操作正确的是
C
C
;A、加热时,晶体溅出坩埚,再加些FeSO4?xH2O
B、加热时,先用小火,后用大火加热至最后
C、加热时,不断用玻璃棒搅拌
D、恒重操作是指加热、冷却、称量这一过程重复两次
(5)实验中出现下列情况时,将对X值有何影响(填“偏大”、“偏小”或“无影响”):灼烧时有黑色固体出现
偏大
偏大
;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气偏小
偏小
.硫酸亚铁是一种重要的食品和饲料添加剂,某课外兴趣小组在实验室用废铁屑与稀硫酸在加热条件下制取FeSO4?X H2O,并测定该晶体中结晶水含量.请回答下列问题:
(1)铁屑表面少量的铁锈(主要成分为Fe2O3?a H2O )对制取硫酸亚铁有无影响______(填“有”或“无”.其原因是______,该步实验的关键是保证______过量(填“硫酸”或“铁屑”);
(2)FeSO4在不同温度下溶解度如下表所示:
由于铁屑中含有C、Si等杂质,为了使FeSO4 溶液的浓度增大,便于反应后分离溶液和残渣.该小组实验时采取了水浴加热和趁热过滤的方法,这样做的主要目的是为了防止______.你认为实验时的水浴温度最好控制在______℃左右.从滤液中获得FeSO4?xH2O,下列操作中不需要的是______;
(A)冷却 (B)蒸发
(C)结晶 (D)洗涤 (E)过滤
(3)以下是测定FeSO4?xH2O中结晶水含量的实验流程.(称量仪器为电子天平)
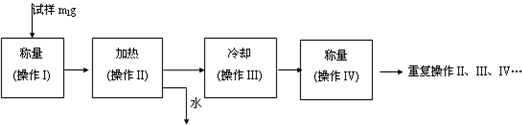
①其加热装置正确的是______
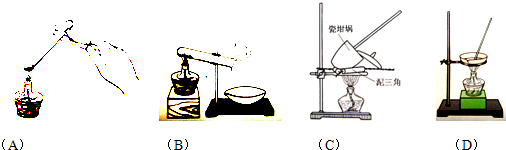
②重复操作II、III、IV,直到连续两次称量结果相差不超过______g;
③操作III必须要在______中(填仪器名称)进行.
(4)以下结晶水含量测定操作正确的是______;
A、加热时,晶体溅出坩埚,再加些FeSO4?xH2O
B、加热时,先用小火,后用大火加热至最后
C、加热时,不断用玻璃棒搅拌
D、恒重操作是指加热、冷却、称量这一过程重复两次
(5)实验中出现下列情况时,将对X值有何影响(填“偏大”、“偏小”或“无影响”):灼烧时有黑色固体出现______;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气______.
查看习题详情和答案>>
(1)铁屑表面少量的铁锈(主要成分为Fe2O3?a H2O )对制取硫酸亚铁有无影响______(填“有”或“无”.其原因是______,该步实验的关键是保证______过量(填“硫酸”或“铁屑”);
(2)FeSO4在不同温度下溶解度如下表所示:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度/g/100g水 | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
(A)冷却 (B)蒸发
(C)结晶 (D)洗涤 (E)过滤
(3)以下是测定FeSO4?xH2O中结晶水含量的实验流程.(称量仪器为电子天平)

①其加热装置正确的是______

②重复操作II、III、IV,直到连续两次称量结果相差不超过______g;
③操作III必须要在______中(填仪器名称)进行.
(4)以下结晶水含量测定操作正确的是______;
A、加热时,晶体溅出坩埚,再加些FeSO4?xH2O
B、加热时,先用小火,后用大火加热至最后
C、加热时,不断用玻璃棒搅拌
D、恒重操作是指加热、冷却、称量这一过程重复两次
(5)实验中出现下列情况时,将对X值有何影响(填“偏大”、“偏小”或“无影响”):灼烧时有黑色固体出现______;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气______.
按要求完成下列问题:
(1)工业上通常把氯气通入石灰乳中来制漂白粉,该反应的化学方程式为
(2)现有:①石灰水; ②水玻璃; ③氯化钡溶液.在上面四种溶液分别通入过量的CO2后,能产生白色浑浊有
(3)硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,而硫酸铁则无这种药效.当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是
查看习题详情和答案>>
(1)工业上通常把氯气通入石灰乳中来制漂白粉,该反应的化学方程式为
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
,还原剂是Cl2
Cl2
.(2)现有:①石灰水; ②水玻璃; ③氯化钡溶液.在上面四种溶液分别通入过量的CO2后,能产生白色浑浊有
②
②
(填序号);所发生反应离子方程式为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
.(3)硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,而硫酸铁则无这种药效.当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是
保护FeSO4不被空气中的氧气氧化成Fe2(SO4)3
保护FeSO4不被空气中的氧气氧化成Fe2(SO4)3
.如果药片已经失效,应如何检验?简述主要步骤:取少量研碎的药片放入烧杯中,加适量的水溶解,然后滴加几滴KSCN溶液
然后滴加几滴KSCN溶液
;现象和结论反应后溶液显血红色,则表明该药片已经失效
反应后溶液显血红色,则表明该药片已经失效
.
硫酸亚铁是一种可用于治疗缺铁性贫血的药剂.硫酸亚铁药片外表包有一层特制的糖衣,以保护硫酸亚铁不被空气中的氧气氧化成硫酸铁(硫酸铁无治疗贫血的药效).
(1)请完成硫酸亚铁在硫酸酸化的条件下与空气中的氧气反应的离子方程式:
Fe2+ O2+ H+-- Fe3++ H2O 反应中的氧化剂是 (填化学式).
(2)试设计一个实验方案,探究某硫酸亚铁药片是否被氧化.请在答题卡的表格中(可以不填满,表格不够时也可自行添加)写出实验步骤以及预期现象和结论.
限选实验试剂:0.1moL?L-1 KSCN、氯水.
(3)步骤2的离子方程式为 .
查看习题详情和答案>>
(1)请完成硫酸亚铁在硫酸酸化的条件下与空气中的氧气反应的离子方程式:
(2)试设计一个实验方案,探究某硫酸亚铁药片是否被氧化.请在答题卡的表格中(可以不填满,表格不够时也可自行添加)写出实验步骤以及预期现象和结论.
限选实验试剂:0.1moL?L-1 KSCN、氯水.
| 实验步骤 | 预期现象和结论 |
| 步骤1:把药品刮去糖衣,用研钵研碎;取少量研碎的粉末在试管中,用少量的蒸馏水溶解; | 硫酸亚铁在蒸馏水中溶解. |
| 步骤2: |
|
| 步骤3: |
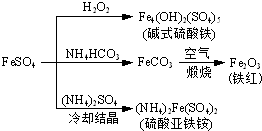 (2013?江苏三模)硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示).下列说法错误的是( )
(2013?江苏三模)硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示).下列说法错误的是( )