摘要:熔融碳酸盐燃料电池.发明于1889年.上世纪的30-60年代在荷兰得到广泛的发展.而且建成了寿命超过40000小时的电池.可应用于中心电站. 现有一个碳酸盐燃料电池.以一定比例和低熔混合物为电解质.操作温度为650℃.在此温度下以镍为催化剂.以煤气(CO.)直接作燃料.其工作原理如图所示. 请回答下列问题: (1)B极为 极.发生 反应.该极发生的电极反应为 , (2)电池总反应为 .
网址:http://m.1010jiajiao.com/timu3_id_357849[举报]
 “氢”既是重要的化工原料,也是未来最理想的新能源.
“氢”既是重要的化工原料,也是未来最理想的新能源.(1)①实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量.则氢气燃烧生成H2O(g)的热化学方程式为
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
.②熔融碳酸盐燃料电池(MCFS)是使用熔融碳酸锂、碳酸钾作电解质的一种新型电池,该电池的工作温度为650℃.负极由镍铬铝合金烧结而成,正极材料为多孔镍,电池反应为:H2+CO+O2=CO2+H2O.下列说法不正确的是
AB
AB
A.负极反应Al-3e-=Al3+ B.燃料气体是氧气
C.正极反应为2CO2+O2+4e-=2CO32- D.该电池也可用烃类作燃料
(2)用CO2和氢气为原料,在催化剂作用下发生如下反应,
2CO2(g)+6H2(g)
| 催化剂 |
①该反应的平衡常数表达式K=
| c(CH3CH2OH).C3(H2O) |
| C2(CO2).C6(H2) |
| c(CH3CH2OH).C3(H2O) |
| C2(CO2).C6(H2) |
②在一定压强下,
| n(H2) |
| n(CO2) |
| 温度(K) | 500 | 600 | 700 | 800 |
| CO2转化率(%) | 60 | 43 | 28 | 15 |
减小
减小
(填“增大”、“减小”或“不变”);上述反应的焓变△H<
<
0(填“>”、“<”或“=”).③其它条件不变,适当提高c(CO2),则乙醇的产量
增大
增大
(填“增大”、“减小”或“不变”,下同.),此时K值不变
不变
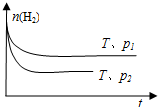
.④在一定温度下,H2的物质的量随时间的变化曲线如图,则p1
<
<
p2(填“>”、“<”或“=”).(2011?南京一模)以天然气为原料经由合成气(C0、H2)制化学品是目前天然气转化利用的主导技术路线. 以甲烷的部分氧化为基础制备甲醚(CH3OCH3)和甲醇的工业流程如下:

(1)甲烷的部分氧化反应如下:
2CH4(g)+O2(g)═2CO(g)+4H2(g);△H=-71.2kJ?mol-1
有研究认为甲烷部分氧化的机理为:
①CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H1=-890.3kJ?mol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g);△H2
③CH4(g)+H2O(g)═CO(g)+3H2(g);△H3=+250.3kJ?mol-1
则△H2=
(2)催化反应室1中合成甲醚的反应为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g),该反应为自发反应,则该反应的△H
(3)催化反应室2中发生如下反应:CO(g)+2H2(g)═CH30H(g)△H<0
在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器分别充入a mol C0和2a mol H2,三个容器的反应 温度分别为T1、T2、T3且恒定不变,在其他条件相同情况下.实验测得反应均进行到t min 时CO 的体积分数如下图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是

(4)如下图为熔融碳酸盐燃料电池的工作原理示意图. 熔融碳酸盐燃料电池的正极反应可表示为:

查看习题详情和答案>>

(1)甲烷的部分氧化反应如下:
2CH4(g)+O2(g)═2CO(g)+4H2(g);△H=-71.2kJ?mol-1
有研究认为甲烷部分氧化的机理为:
①CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H1=-890.3kJ?mol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g);△H2
③CH4(g)+H2O(g)═CO(g)+3H2(g);△H3=+250.3kJ?mol-1
则△H2=
+247.3kJ?mol-1
+247.3kJ?mol-1
.(2)催化反应室1中合成甲醚的反应为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g),该反应为自发反应,则该反应的△H
<
<
0 (填“<”、“>”或“=”)(3)催化反应室2中发生如下反应:CO(g)+2H2(g)═CH30H(g)△H<0
在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器分别充入a mol C0和2a mol H2,三个容器的反应 温度分别为T1、T2、T3且恒定不变,在其他条件相同情况下.实验测得反应均进行到t min 时CO 的体积分数如下图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是
Ⅲ
Ⅲ
;都达到化学平衡状态时,C0转化率最小的是Ⅲ
Ⅲ
.
(4)如下图为熔融碳酸盐燃料电池的工作原理示意图. 熔融碳酸盐燃料电池的正极反应可表示为:
O2+4e-+2CO2═2CO32-
O2+4e-+2CO2═2CO32-
.
CO和H2可作为能源和化工原料,应用十分广泛.
(1)已知:C(s)+O2 (g)═CO2(g)△H1=-393.5kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ?mol-1
C(s)+H2O(g)═CO(g)+H2(g)△H3=+131.3kJ?mol-1
则反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g)的△H=
标准状况下的煤炭气(CO、H2)33.6L与氧气反应生成CO2和H2O,反应过程中转移
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的.负极的电极反应式为
(3)密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示.
CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示.

①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是
查看习题详情和答案>>
(1)已知:C(s)+O2 (g)═CO2(g)△H1=-393.5kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ?mol-1
C(s)+H2O(g)═CO(g)+H2(g)△H3=+131.3kJ?mol-1
则反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g)的△H=
-524.8
-524.8
kJ?mol-1.标准状况下的煤炭气(CO、H2)33.6L与氧气反应生成CO2和H2O,反应过程中转移
3
3
mol电子.(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的.负极的电极反应式为
CO-2e-+CO32-═2CO2、H2-2e-+CO32-═CO2+H2O;
CO-2e-+CO32-═2CO2、H2-2e-+CO32-═CO2+H2O;
;则该电池的正极反应式是O2+4e-+2CO2═2CO32-
O2+4e-+2CO2═2CO32-
.(3)密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)
 CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示.
CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示.
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=
1
1
;此时在B点时容器的体积VB小于
小于
10L(填“大于”、“小于”或“等于”).②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA
大于
大于
tC(填“大于”、“小于”或“等于”).③在不改变反应物用量情况下,为提高CO转化率可采取的措施是
降温、加压,将甲醇从混合体系中分离出来
降温、加压,将甲醇从混合体系中分离出来
.熔融碳酸盐燃料电池(MCFC)是使用熔融碳酸锂、碳酸钾作电解质的一种新型电池,该电池的工作温度为650℃.负极由镍铬铝合金烧结而成,正极材料为多孔镍,电池反应为:H2+CO+O2═CO2+H2O.下列说法不正确的是( )
查看习题详情和答案>>
 (2010?西城区模拟)熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池,其工作原理如图所示:
(2010?西城区模拟)熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池,其工作原理如图所示:(1)电极b是该燃料电池的(填“正”或“负”)
正
正
极.(2)若以氢气为燃料,则A是(填化学式)
H2
H2
,Y是(填化学式)CO2
CO2
;CO32-的移动方向是移向(填“电极a”或“电极b”)电极a
电极a
;电极b的电极反应是O2+4e-+2CO2═2CO32-
O2+4e-+2CO2═2CO32-
.(3)若以一氧化碳为燃料,则反应非常慢,可通过反应CO+H2O=CO2+H2,使一氧化碳转化为氢气再进一步反应.
①已知25℃时,C(s)+O2(g)═CO2(g)△H=-394kJ/mol:
H2(g)+
| 1 |
| 2 |
C(s)+
| 1 |
| 2 |
-41kJ/mol
-41kJ/mol
.②已知反应CO(g)+H2O(g)?CO2(g)+H2(g)在某温度时的平衡常数是9.0.若反应开始时,一氧化碳和水蒸气的浓度都是0.01mol/L,则一氧化碳在此反应条件下的转化率是
75%
75%
.