摘要:已知298K时.SO2(g)+O2(g)=SO3(g),△H=-98.5kJ/mol.在相同温度和压强下.向密闭容器中通入1mol SO2和0.5 molO2.达到平衡时放出热量Q1,向另一个相同体积的密闭容器中通入2mol SO2和1mol O2.达到平衡时放出热量Q2.则下列关系式正确的是( ) A.Q1= B.Q1< C.Q1<Q2=197kJ D.Q1=Q2<197kJ
网址:http://m.1010jiajiao.com/timu3_id_357807[举报]
(2010?福州一模)已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
查看习题详情和答案>>
(2012?广东)难溶性杂卤石(K2SO4?MgSO4?2CaSO4?2H2O)属于“呆矿”,在水中存在如下平衡
K2SO4?MgSO4?2CaSO4?2H2O(s)?2Ca2++2K++Mg2++4
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1: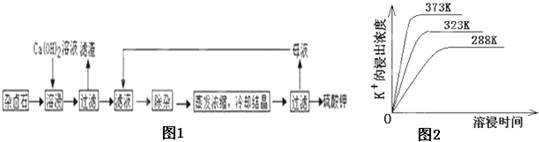
(1)滤渣主要成分有
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
(3)“除杂”环节中,先加入
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+
?CaCO3(s)+
已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K
查看习题详情和答案>>
K2SO4?MgSO4?2CaSO4?2H2O(s)?2Ca2++2K++Mg2++4
| SO | 2- 4 |
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:

(1)滤渣主要成分有
CaSO4
CaSO4
和Mg(OH)2
Mg(OH)2
以及未溶杂卤石.(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
氢氧根与镁离子结合使平衡向右移动,钾离子变多
氢氧根与镁离子结合使平衡向右移动,钾离子变多
.(3)“除杂”环节中,先加入
K2CO3
K2CO3
溶液,经搅拌等操作后,过滤,再加入H2SO4
H2SO4
溶液调滤液PH至中性.(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①
在同一时间K+的浸出浓度大
在同一时间K+的浸出浓度大
②反应速率加快,平衡时溶浸时间短
反应速率加快,平衡时溶浸时间短
;(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+
| CO | 2- 3 |
| SO | 2- 4 |
已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K
1.75×104
1.75×104
(计算结果保留三位有效数字).已知298K时,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1,推测含1mol HCl的稀溶液与含1mol NH3的稀溶液反应放出的热量( )
| A、小于57.3 kJ | B、等于57.3 kJ | C、大于57.3 kJ | D、无法确定 |