网址:http://m.1010jiajiao.com/timu3_id_357503[举报]
 ⅠA、B、C、D四种元素在周期表中分别处于元素X的四周(如图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的.试确定:
ⅠA、B、C、D四种元素在周期表中分别处于元素X的四周(如图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的.试确定:(1)各元素的符号:
A:
(2)写出C、D、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序:
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:
ⅡFe3+和I-在水溶液中的反应如下:2I-+2Fe3+?2Fe2++I2(水溶液),
(1)该反应的平衡常数K的表达式为:K=
| c2(Fe2+)×c(I2) |
| c2(I-)×c2(Fe3+) |
| c2(Fe2+)×c(I2) |
| c2(I-)×c2(Fe3+) |
[物质的浓度用“c(物质)”表示].当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡
(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K[c(I-)]m[c(Fe3+)]n(其中K为常数)
| c(I-)(mol/L) | c(Fe3+)(mol/L) | v[mol/(L?s)] | |
| (1) | 0.20 | 0.80 | 0.032K |
| (2) | 0.60 | 0.40 | 0.144K |
| (3) | 0.80 | 0.20 | 0.128K |
①在v=K[c(I-)]m[c(Fe3+)]n中,m、n的值为
A.m=1、n=1 B.m=1、n=2 C.m=2、n=1 D.m=2、n=2
②I-浓度对反应速率的影响
(1)各元素的符号:
A:______,B:______,C:______,D:______,X:______.
(2)写出C、D、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序:______.
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:______.
ⅡFe3+和I-在水溶液中的反应如下:2I-+2Fe3+?2Fe2++I2(水溶液),
(1)该反应的平衡常数K的表达式为:K=______.
[物质的浓度用“c(物质)”表示].当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡______移动(填“向右”、“向左”、“不”).
(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K[c(I-)]m[c(Fe3+)]n(其中K为常数)
| c(I-)(mol/L) | c(Fe3+)(mol/L) | v[mol/(L?s)] | |
| (1) | 0.20 | 0.80 | 0.032K |
| (2) | 0.60 | 0.40 | 0.144K |
| (3) | 0.80 | 0.20 | 0.128K |
①在v=K[c(I-)]m[c(Fe3+)]n中,m、n的值为______.
A.m=1、n=1 B.m=1、n=2 C.m=2、n=1 D.m=2、n=2
②I-浓度对反应速率的影响______Fe3+浓度对反应速率的影响(填“>”、“<”或“=”).
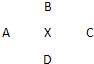
(1)各元素的符号:
A:______,B:______,C:______,D:______,X:______.
(2)写出C、D、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序:______.
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:______.
ⅡFe3+和I-在水溶液中的反应如下:2I-+2Fe3+?2Fe2++I2(水溶液),
(1)该反应的平衡常数K的表达式为:K=______.
[物质的浓度用“c(物质)”表示].当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡______移动(填“向右”、“向左”、“不”).
(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K[c(I-)]m[c(Fe3+)]n(其中K为常数)
| c(I-)(mol/L) | c(Fe3+)(mol/L) | v[mol/] | |
| (1) | 0.20 | 0.80 | 0.032K |
| (2) | 0.60 | 0.40 | 0.144K |
| (3) | 0.80 | 0.20 | 0.128K |
①在v=K[c(I-)]m[c(Fe3+)]n中,m、n的值为______.
A.m=1、n=1 B.m=1、n=2 C.m=2、n=1 D.m=2、n=2
②I-浓度对反应速率的影响______Fe3+浓度对反应速率的影响(填“>”、“<”或“=”).
 查看习题详情和答案>>
查看习题详情和答案>>
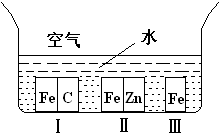 A、【供选学《化学与生活》考生作答】
A、【供选学《化学与生活》考生作答】(1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是
(2)氟氯代烷是一种破坏臭氧层的物质.在大气平流层中,氟氯代烷受紫外线的照射分解出氯原子,氯原子参与下列有关反应:
①Cl+O3→ClO+O2;②O3→O+O2;③ClO→Cl+O2
上列反应的总反应式是
(3)碳酸氢钠是常见的疏松剂,主要是因为它在加热条件下产生了气体,使食品变得疏松.试写出碳酸氢钠受热分解的化学方程式
(4)垃圾资源化的方法是
A、填埋 B、焚烧 C、堆肥法 D、分类回收法
B【供选学《化学反应原理》考生作答】
设反应①Fe(s)+CO2(g)═FeO(s)+CO(g)的平衡常数为K1.反应②Fe(s)+H2O(g)═FeO(s)+H2(g)的平衡常数K2,在不同温度下,K1、K2的值如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(2)现有反应③CO2(g)+H2(g)═CO(g)+H2O(g)写出该反应的平衡常数K3的数学表达式:K3═
(3)书写热化学方程式:
①1mol N2(g)与适量O2(g)起反应,生成NO2(g),吸收68KJ热量:
②NH3(g)燃烧生成NO2(g)和H2O(g),已知
(1)2H2(g)+O2(g)═2H2O(g)△H═-483.6kJ/mol
(2)N2(g)+2O2(g)═2NO2(g)△H═+67.8kJ/mol
1,N2(g)+3H2(g)═2NH3(g)△H═-92.0kJ/mol
NH3(g)燃烧生成NO2(g)和H2O (g)热化学方程式:
Ⅰ(10分) A、B、C、D四种元素在周期表中分别处于元素X的四周(如下图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的。试确定:
(1)各元素的符号:
A:_____,B:____,C:____,D:_____,X:_____。
(2)写出C、D、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序:___________。
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:__________________。
Ⅱ(8分)Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+![]() 2Fe2++I2(水溶液),
2Fe2++I2(水溶液),
⑴该反应的平衡常数K的表达式为:K= ___________________________
[物质的浓度用“c(物质)”表示]。当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡________移动(填“向右”、“向左”、“不”)。
⑵上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K[c(I-)]m[c(Fe3+)]n(其中K为常数)
| c(I-)(mol/L) | c(Fe3+)(mol/L) | v[mol/(L?s)] | |
| ⑴ | 0.20 | 0.80 | 0.032K |
| ⑵ | 0.60 | 0.40 | 0.144K |
| ⑶ | 0.80 | 0.20 | 0.128K |
通过所给的数据计算得知:
①在v=K[c(I-)]m[c(Fe3+)]n中,m、n的值为_________。
A. m=1、n=1 B. m=1、n=2 C. m=2、n=1 D. m=2、n=2
②I-浓度对反应速率的影响_______Fe3+浓度对反应速率的影响(填“>”、“<”或“=”)。
查看习题详情和答案>>