摘要:(1)1﹕50.根据勒沙特列原理.过量而廉价的氧气可提高二氧化硫的转化率.(2)废气中每小时排放SO2的体积为1000×5×0.2%=10L.每小时氨气与废气中SO2混合的体积比为2﹕1.恰好与反应中生成(NH4)2SO4的物质的量一致.(3)3.54t硫酸铵.0.91t氨气
网址:http://m.1010jiajiao.com/timu3_id_357435[举报]
2010年11月30日,联合国气候大会在墨西哥坎昆召开,讨论全球变暖问题.二氧化碳是主要的温室气体,请根据题目要求,回答下列问题:
(Ⅰ)二氧化碳与氢氧化钠反应生成盐.
标准状况下,2.24LCO2通入150mL 1mol/LNaOH溶液中,气体完全被吸收.所得盐溶液中各种离子浓度由大到小的顺序为: .
(Ⅱ)将CO2转化成有机物可有效实现碳循环,利用催化剂可以将CO2和H2转化成甲醇.反应的化学方程式为3H2(g)+CO2(g)?CH3OH(g)+H2O(g).
(1)利用此反应可设计成酸性环境下的原电池,减少CO2排放量.则原电池正极的电极反应式为 .
(2)某温度下,在密闭容器内,发生上述反应,并测得不同时间CO2和H2的浓度如表
请回答下列问题
①在上述条件下反应能自发进行,则反应的△H 0(填>,<,=).前2s内的平均反应速率v(CO2)= .
②保持温度不变,在另一容器中进行上述反应,某一时刻测得c(CO2)=5.00×10-2mol/L,
c(H2)=2.00×10-1mol/L,c(CH3OH)=5.00×10-2mol/L,c(H2O)=5.00×10-1mol/L,此时反应向 (正或逆)反应方向进行(若是平衡状态,此空不填).
③上述反应达到平衡后,恒温恒容条件下,密闭容器中再充入1.00×10-3mol/L CO2和3.00×10-3mol/LH2,达新平衡后CO2百分含量将 (增大、减小或不变).
查看习题详情和答案>>
(Ⅰ)二氧化碳与氢氧化钠反应生成盐.
标准状况下,2.24LCO2通入150mL 1mol/LNaOH溶液中,气体完全被吸收.所得盐溶液中各种离子浓度由大到小的顺序为:
(Ⅱ)将CO2转化成有机物可有效实现碳循环,利用催化剂可以将CO2和H2转化成甲醇.反应的化学方程式为3H2(g)+CO2(g)?CH3OH(g)+H2O(g).
(1)利用此反应可设计成酸性环境下的原电池,减少CO2排放量.则原电池正极的电极反应式为
(2)某温度下,在密闭容器内,发生上述反应,并测得不同时间CO2和H2的浓度如表
| 时间/S | c(CO2)mol/L | c(H2)mol/L |
| 0 | 1.00×10-1 | 3.00×10-1 |
| 1 | 8.50×10-2 | 2.55×10-1 |
| 2 | 6.50×10-2 | 1.95×10-1 |
| 3 | 5.50×10-2 | 1.65×10-1 |
| 4 | 5.00×10-2 | 1.50×10-1 |
| 5 | 5.00×10-2 | 1.50×10-1 |
①在上述条件下反应能自发进行,则反应的△H
②保持温度不变,在另一容器中进行上述反应,某一时刻测得c(CO2)=5.00×10-2mol/L,
c(H2)=2.00×10-1mol/L,c(CH3OH)=5.00×10-2mol/L,c(H2O)=5.00×10-1mol/L,此时反应向
③上述反应达到平衡后,恒温恒容条件下,密闭容器中再充入1.00×10-3mol/L CO2和3.00×10-3mol/LH2,达新平衡后CO2百分含量将
Ⅰ工业上铜的冶炼常采取火法熔炼工艺.以辉铜矿(主要成分 Cu2S)为原料,该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ?mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ?mol-1
反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=
在上述工业生产过程中产生的SO2气体直接排放会污染大气.工业上常用氨水吸收SO2,反应的化学方程式为
Ⅱ大气污染的另一个重要问题是臭氧层的破坏.为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4(g)+H2(g)
CHCl3(g)+HCl(g).此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为 77℃,CHCl3的沸点为 61.2℃.
如果不考虑反应过程中的副反应,在一个密闭容器中发生上述反应,该反应达到平衡后,测得下表中的数据.
请回答下列问题:
(1)实验1中,CCl4的转化率a
(2)在实验2的平衡体系中,再加入0.5mol?L-1CCl4和1mol?L-1HCl,平衡将向
(3)120℃,在相同条件的密闭容器中,分别进行实验3、4,测得CCl4的转化率(x)和生成物中CHCl3的体积分数(y)随时间(t)的变化关系如图(图中实线是CCl4转化率变化曲线,虚线是产物中CHCl3的体积分数变化曲线).
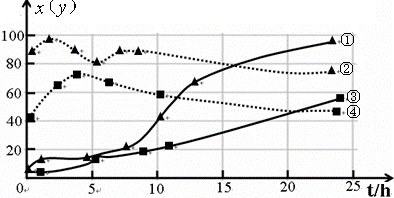
图中的四条线中,表示H2起始浓度为2mol?L-1实验中CCl4的转化率(x)变化曲线是
查看习题详情和答案>>
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ?mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ?mol-1
反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=
-217.4KJ/mol
-217.4KJ/mol
.在上述工业生产过程中产生的SO2气体直接排放会污染大气.工业上常用氨水吸收SO2,反应的化学方程式为
SO2+2NH3?H2O=(NH4)2SO3+H2O或 SO2+NH3?H2O=NH4HSO3
SO2+2NH3?H2O=(NH4)2SO3+H2O或 SO2+NH3?H2O=NH4HSO3
.Ⅱ大气污染的另一个重要问题是臭氧层的破坏.为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4(g)+H2(g)
| 催化剂 |
| △ |
如果不考虑反应过程中的副反应,在一个密闭容器中发生上述反应,该反应达到平衡后,测得下表中的数据.
| 实验序号 | 温度℃ | 初始CCl4浓度(mol?L-1) | 初始H2浓度(mol?L-1) | CCl4的转化率 |
| 1 | 110 | 0.8 | 1.2 | a |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 2 | x |
| 4 | 120 | 1 | 4 |
(1)实验1中,CCl4的转化率a
大于
大于
50%(填“大于”“小于”“等于”);(2)在实验2的平衡体系中,再加入0.5mol?L-1CCl4和1mol?L-1HCl,平衡将向
逆
逆
反应方向移动(填“正”、“逆”或“不移动”).(3)120℃,在相同条件的密闭容器中,分别进行实验3、4,测得CCl4的转化率(x)和生成物中CHCl3的体积分数(y)随时间(t)的变化关系如图(图中实线是CCl4转化率变化曲线,虚线是产物中CHCl3的体积分数变化曲线).

图中的四条线中,表示H2起始浓度为2mol?L-1实验中CCl4的转化率(x)变化曲线是
③
③
(选填序号).根据上图曲线,氢气的起始浓度为4mol/L
4mol/L
有利于提高CCl4的平衡转化率.(2011?广州模拟)为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化剂作用下,通过下列反应:CCl4+H2?CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3).此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应).
①此反应的化学平衡常数表达式为
,在110℃时平衡常数为
②实验1中,CCl4的转化率A
③实验2中,10h后达到平衡,H2的平均反应速率为
④实验3中,B的值
A.等于50%; B.大于50%
C.小于50%; D.从本题资料无法判断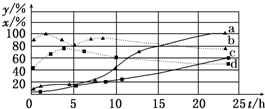
(2)120℃时,在相同条件的密闭容器中,分别进行H2的初始浓度为2mol/L和4mol/L的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线).
①在图中的四条线中,表示H2起始浓度为2mol/L的实验消耗CCl4的百分率变化曲线是
②根据如图曲线,氢气的起始浓度为
查看习题详情和答案>>
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应).
| 实验序号 | 温度℃ | 初始CCl4浓度(mol/L) | 初始H2浓度(mol/L) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
| c(CHCl3)?c(HCl) |
| c(CCl4)?c(H2) |
| c(CHCl3)?c(HCl) |
| c(CCl4)?c(H2) |
1
1
.②实验1中,CCl4的转化率A
大于
大于
50%(填“大于”、“小于”或“等于”).③实验2中,10h后达到平衡,H2的平均反应速率为
0.05mol/(L?h)
0.05mol/(L?h)
.④实验3中,B的值
D
D
(选填序号).A.等于50%; B.大于50%
C.小于50%; D.从本题资料无法判断

(2)120℃时,在相同条件的密闭容器中,分别进行H2的初始浓度为2mol/L和4mol/L的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线).
①在图中的四条线中,表示H2起始浓度为2mol/L的实验消耗CCl4的百分率变化曲线是
c
c
(选填序号).②根据如图曲线,氢气的起始浓度为
4
4
mol/L时,有利于提高CCl4的平衡转化率和产物中CHCl3的百分含量.你判断的依据是从图中可见,4mol/L的a、b曲线比2mol/L的c、d曲线CCl4转化率和产物中CHCl3的百分率的数值均高
从图中可见,4mol/L的a、b曲线比2mol/L的c、d曲线CCl4转化率和产物中CHCl3的百分率的数值均高
.(2013?杭州一模)某种甲酸酯水解反应方程式为:
HCOOR(l)+H2O(l)?HCOOH(l)+ROH (l)△H>0
某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始浓度如下表:
甲酸酯转化率在温度T1下随反应时间(t)的变化如图:
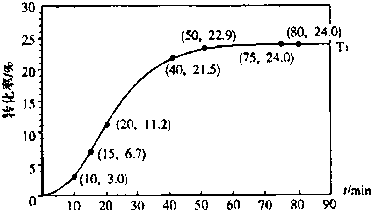
根据上述条件,计算不同时间范围内甲酸醋的平均反应速率,结果见下表:
(1)该反应的平衡常数K 的表达式
(不要求计算);T1温度下平衡体系中.c(ROH )为
(2)15~20min范围内用甲酸酯表示的平均反应速率为
(3)根据题给数据分析,从影响反应速率的角度来看,生成物甲酸在该反应中还起到了
查看习题详情和答案>>
HCOOR(l)+H2O(l)?HCOOH(l)+ROH (l)△H>0
某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始浓度如下表:
| 组分 | HCOOR | H2O | HCOOH } | ROH |
| 物质的量浓度/mol?L-1’ | 1.00 | 1.99 | 0.01 | 0.52 |

根据上述条件,计算不同时间范围内甲酸醋的平均反应速率,结果见下表:
| 反应时间/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均速率/10-3mol?L-1?min-1 | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
| c(ROH)c(HCOOH) |
| c(HCOOR)c(H2O) |
| c(ROH)c(HCOOH) |
| c(HCOOR)c(H2O) |
0.76
0.76
mol?L一1(2)15~20min范围内用甲酸酯表示的平均反应速率为
0.009
0.009
mol?L-1?min-1,(不要求写出计算过程).(3)根据题给数据分析,从影响反应速率的角度来看,生成物甲酸在该反应中还起到了
催化剂
催化剂
的作用.以下为五种有机物的有关信息,根据表中信息回答问题。
| A | B | D | E | F |
| ①由C、H、O 三种元素组成的液体; ②与水任意比例互溶。 | 其产量用来衡量一个国家的石油化工水平。 | 比例模型为: | ①可用于除水垢 ②在低于16.6℃时,凝固成冰一样的晶体。 | 由5个原子组成的10个电子的共价分子。 |
①有毒 ②无色无味 ③密度比水小 ④与酸性高锰酸钾溶液反应使其褪色
⑤在海带提碘实验中作萃取剂从碘水中提取碘单质
⑥在热Cu丝作用下生成相对分子质量比它小2的有机物
A.①③⑤ B.②③④ C.③④⑥ D.④⑤⑥
(2)B的电子式为 ,把一定体积的B、F混合气体通过溴水,有 反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为 g。(可能用到的相对原子质量:H 1;C 12;O 16;Br 80)
(3)工业上,D来源于煤干馏后的液态产物煤焦油。D在浓硫酸、50~60℃水浴中与浓硝酸发生取代反应,生成的有机物的结构简式为 。
(4)写出用18O标记的A与不含18O的E在一定条件下发生反应的化学方程式(注明反应条件)。 。下图为实验室进行该反应时的装置图,其中有 处错误。
 查看习题详情和答案>>
查看习题详情和答案>>