题目内容
Ⅰ工业上铜的冶炼常采取火法熔炼工艺.以辉铜矿(主要成分 Cu2S)为原料,该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ?mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ?mol-1
反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=
在上述工业生产过程中产生的SO2气体直接排放会污染大气.工业上常用氨水吸收SO2,反应的化学方程式为
Ⅱ大气污染的另一个重要问题是臭氧层的破坏.为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4(g)+H2(g)
CHCl3(g)+HCl(g).此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为 77℃,CHCl3的沸点为 61.2℃.
如果不考虑反应过程中的副反应,在一个密闭容器中发生上述反应,该反应达到平衡后,测得下表中的数据.
请回答下列问题:
(1)实验1中,CCl4的转化率a
(2)在实验2的平衡体系中,再加入0.5mol?L-1CCl4和1mol?L-1HCl,平衡将向
(3)120℃,在相同条件的密闭容器中,分别进行实验3、4,测得CCl4的转化率(x)和生成物中CHCl3的体积分数(y)随时间(t)的变化关系如图(图中实线是CCl4转化率变化曲线,虚线是产物中CHCl3的体积分数变化曲线).
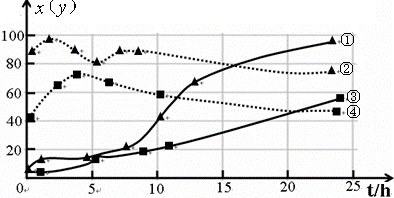
图中的四条线中,表示H2起始浓度为2mol?L-1实验中CCl4的转化率(x)变化曲线是
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ?mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ?mol-1
反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=
-217.4KJ/mol
-217.4KJ/mol
.在上述工业生产过程中产生的SO2气体直接排放会污染大气.工业上常用氨水吸收SO2,反应的化学方程式为
SO2+2NH3?H2O=(NH4)2SO3+H2O或 SO2+NH3?H2O=NH4HSO3
SO2+2NH3?H2O=(NH4)2SO3+H2O或 SO2+NH3?H2O=NH4HSO3
.Ⅱ大气污染的另一个重要问题是臭氧层的破坏.为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4(g)+H2(g)
| 催化剂 |
| △ |
如果不考虑反应过程中的副反应,在一个密闭容器中发生上述反应,该反应达到平衡后,测得下表中的数据.
| 实验序号 | 温度℃ | 初始CCl4浓度(mol?L-1) | 初始H2浓度(mol?L-1) | CCl4的转化率 |
| 1 | 110 | 0.8 | 1.2 | a |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 2 | x |
| 4 | 120 | 1 | 4 |
(1)实验1中,CCl4的转化率a
大于
大于
50%(填“大于”“小于”“等于”);(2)在实验2的平衡体系中,再加入0.5mol?L-1CCl4和1mol?L-1HCl,平衡将向
逆
逆
反应方向移动(填“正”、“逆”或“不移动”).(3)120℃,在相同条件的密闭容器中,分别进行实验3、4,测得CCl4的转化率(x)和生成物中CHCl3的体积分数(y)随时间(t)的变化关系如图(图中实线是CCl4转化率变化曲线,虚线是产物中CHCl3的体积分数变化曲线).

图中的四条线中,表示H2起始浓度为2mol?L-1实验中CCl4的转化率(x)变化曲线是
③
③
(选填序号).根据上图曲线,氢气的起始浓度为4mol/L
4mol/L
有利于提高CCl4的平衡转化率.分析:Ⅰ、根据盖斯定律,由已知热化学方程式乘以合适的系数进行适当的加减,反应热也乘以相应的系数进行相应的加减;
Ⅱ、(1)实验1和实验2的反应温度相同,所以其平衡常数相同,利用平衡常数相等,可以求出实验1中CCl4的平衡转化率,然后与50%比较;
(2)根据速率概念和不同温度下的平衡常数来判断;
(3)依据图象曲线变化趋势分析判断,氢气浓度越大反应越快,消耗CCl4的百分率变化就越快,相反就比较慢,据此判断;由图象可知,氢气的浓度为4mol/L,CCl4的平衡转化率和产物中CHCl3的百分含量均得到提高;
Ⅱ、(1)实验1和实验2的反应温度相同,所以其平衡常数相同,利用平衡常数相等,可以求出实验1中CCl4的平衡转化率,然后与50%比较;
(2)根据速率概念和不同温度下的平衡常数来判断;
(3)依据图象曲线变化趋势分析判断,氢气浓度越大反应越快,消耗CCl4的百分率变化就越快,相反就比较慢,据此判断;由图象可知,氢气的浓度为4mol/L,CCl4的平衡转化率和产物中CHCl3的百分含量均得到提高;
解答:解:Ⅰ、①2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ?mol-1
②2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ?mol-1
依据盖斯定律(①+②)×
得到 Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.4KJ/mol;
工业上常用氨水吸收SO2,二氧化硫是酸性氧化物和一水合氨反应生成亚硫酸铵或亚硫酸氢铵,反应的化学方程式为:SO2+2NH3?H2O=(NH4)2SO3+H2O或 SO2+NH3?H2O=NH4HSO3;
故答案为:-217.4KJ/mol;SO2+2NH3?H2O=(NH4)2SO3+H2O或 SO2+NH3?H2O=NH4HSO3 ;
Ⅱ、(1)实验1中,设平衡时四氯化碳的浓度变化量为amol/L,则:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 0.8 1.2 0 0
反应(mol/L ) a a a a
平衡(mol/L) 0.8-a 1.2-a a a
则
=1,解得a=0.48,则CCl4的转化率为
×100%=60%>50%;
故答案为:大于;
(2)在此实验的平衡体系中,再加入0.5mol CCl4和1.0mol HCl,则会导致
增大,大于1,则平衡逆向进行,
故答案为:逆反应;
(3)由图象可知,氢气浓度越大反应越快,消耗CCl4的百分率变化就越快,相反就比较慢,所以H2起始浓度为2mol/L时,消耗CCl4的百分率变化曲线是③;
由图象可知,①②表示氢气的浓度为4mol/L的曲线,CCl4的平衡转化率和产物中CHCl3的百分含量均得到提高,
故答案为:③,4mol/L;
②2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ?mol-1
依据盖斯定律(①+②)×
| 1 |
| 3 |
工业上常用氨水吸收SO2,二氧化硫是酸性氧化物和一水合氨反应生成亚硫酸铵或亚硫酸氢铵,反应的化学方程式为:SO2+2NH3?H2O=(NH4)2SO3+H2O或 SO2+NH3?H2O=NH4HSO3;
故答案为:-217.4KJ/mol;SO2+2NH3?H2O=(NH4)2SO3+H2O或 SO2+NH3?H2O=NH4HSO3 ;
Ⅱ、(1)实验1中,设平衡时四氯化碳的浓度变化量为amol/L,则:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),
起始(mol/L ) 0.8 1.2 0 0
反应(mol/L ) a a a a
平衡(mol/L) 0.8-a 1.2-a a a
则
| a×a |
| (0.8-a)(1.2-a) |
| 0.48mol/L |
| 0.8mol/L |
故答案为:大于;
(2)在此实验的平衡体系中,再加入0.5mol CCl4和1.0mol HCl,则会导致
| c(CHCl3)c(HCl) |
| c(H2c(CCl4)) |
故答案为:逆反应;
(3)由图象可知,氢气浓度越大反应越快,消耗CCl4的百分率变化就越快,相反就比较慢,所以H2起始浓度为2mol/L时,消耗CCl4的百分率变化曲线是③;
由图象可知,①②表示氢气的浓度为4mol/L的曲线,CCl4的平衡转化率和产物中CHCl3的百分含量均得到提高,
故答案为:③,4mol/L;
点评:本题考查化学平衡计算、化学反应速率计算、化学平衡常数计算与应用、影响化学平衡的因素,难度中等,注意掌握三段式计算与平衡常数的应用.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目