摘要:某湿度下可逆反应N2O4(g)==2NO2-Q,在密闭容器中达到化学平衡,下列说法正确的是 ( )C. ①加压时,将使正反应速度增大,②保持体积不变,加入少量的NO2将使正反应速度减小,③保持体积不变,加入少量N2O4,再次达到化学平衡时,体系颜色变深,④保持体积不变,升高温度,再次达到化学平衡时体系颜色变深. A. ①④ B. ②③④ C. ①③④ D. ①②③④
网址:http://m.1010jiajiao.com/timu3_id_357416[举报]
某温度下将N2和H2充入一恒容的密闭容器中,发生可逆反应:N2+ 3H2 2NH3。 某一时刻用下列各组内两种物质表示的该反应速率,其中正确的是
2NH3。 某一时刻用下列各组内两种物质表示的该反应速率,其中正确的是
 2NH3。 某一时刻用下列各组内两种物质表示的该反应速率,其中正确的是
2NH3。 某一时刻用下列各组内两种物质表示的该反应速率,其中正确的是 [ ]
A.v(N2)= 0.01 mol/(L·s),v(H2)= 0.02 mol/(L·s)
B.v(H2)= 0.02 mol/(L·s),v(NH3)= 1.2 mol/(L·min)
C.v(N2)= 0.01 mol/(L·s),v(NH3)= 1.2 mol/(L·min)
D.v(H2)= 0.06 mol/(L·s) ,v(NH3)= 0.4 mol/(L·min)
查看习题详情和答案>>
B.v(H2)= 0.02 mol/(L·s),v(NH3)= 1.2 mol/(L·min)
C.v(N2)= 0.01 mol/(L·s),v(NH3)= 1.2 mol/(L·min)
D.v(H2)= 0.06 mol/(L·s) ,v(NH3)= 0.4 mol/(L·min)
已知反应:N2(g)+3H2(g)?2NH3(g)△H<0.某温度下,N2的平衡转化率(α)与体系总压强(P)的关系如图甲所示.将1mol N2与3mol H2置于10L韵密闭容器中,反应达到平衡后,下列说法正确的是( )

| A、由图甲知,A点N2的平衡浓度为0.2mol?L-1 | B、由图甲知,B点N2、H2、NH3的平衡浓度之比为1:3:2 | C、达到平衡后,缩小容器体积,则反应速率变化图象可以用图乙表示 | D、压强为0.5MPa时,在不同温度下N2的转化率与温度的关系如图丙,则T1<T2 |
已知某温度下:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1mol N2、3mol H2,B中通入0.5mol N2、1.5mol H2,反应一段时间后,A、B中均达到平衡状态.下列判断正确的是( )
查看习题详情和答案>>
(10分)(1)①根据图示,写出反应的热化学方程式: 。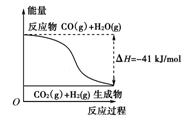
②根据如图所示情况,判断下列说法中正确的是( )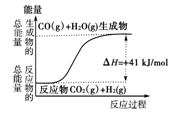
| A.其热化学方程式为:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+41 kJ/mol |
| B.该反应为吸热反应 |
| C.该反应为放热反应 |
| D.当H2O为液态时,其反应热值小于41 kJ/mol |
(3)如图是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为: 。
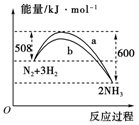
a、b两条曲线产生区别的原因很可能是 。 查看习题详情和答案>>
 2NH3(g) 达平衡的标志是
2NH3(g) 达平衡的标志是