网址:http://m.1010jiajiao.com/timu3_id_357368[举报]
工业制硝酸的主要反应为:4NH3(g)+5O2(g) 4NO(g)+6 H2O(g)△H。
4NO(g)+6 H2O(g)△H。
(1)已知氢气的燃烧热为285.8 kJ/mol。
N2(g)+3H2(g)=2NH3(g)? △H=-92.4 kJ/mol;
H2O(1)=H2O(g)△H=+44.0 kJ/mol;
N2(g)+O2(g)=2NO(g)△H=+180.6 kJ/mol。
则上述工业制硝酸的主要反应的△H=???????????????????????? 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:

①反应在第2 min到第4 min时,O2的平均反应速率为?????????????????? 。
②反应在第6 min时改变了条件,改变的条件可能是????????? (填序号)。
A.使用催化剂????? B.升高温度? C.减小压强????? D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g) 4NO(g)+6 H2 O(g)达到平衡状态的是??????? (填序号)。
4NO(g)+6 H2 O(g)达到平衡状态的是??????? (填序号)。
A.单位时间内生成n mol NO的向时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):u(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH3OH-O2燃料电池的工作原理如图所示。

①该电池工作时,b口通入的物质为____????? 。
②该电池正极的电极反应式为:???????????????????????? 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图所示)的过程中,发现溶液逐渐变浑浊并有气泡产生,其原因可能是?????????????????????????????????? (用相关的离子方程式表示)。

查看习题详情和答案>>
工业制硝酸的主要反应为:4NH3(g)+5O2(g)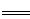 4NO(g)+6 H2O(g)△H。
4NO(g)+6 H2O(g)△H。
(1)已知氢气的燃烧热为285.8 kJ/mol。
N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ/mol;
H2O(1)=H2O(g)△H=+44.0 kJ/mol;
N2(g)+O2(g)=2NO(g)△H=+180.6 kJ/mol。
则上述工业制硝酸的主要反应的△H= 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表: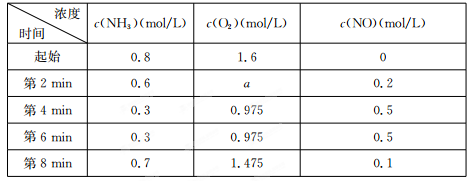
①反应在第2 min到第4 min时,O2的平均反应速率为 。
②反应在第6 min时改变了条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g) 4NO(g)+6 H2 O(g)达到平衡状态的是 (填序号)。
4NO(g)+6 H2 O(g)达到平衡状态的是 (填序号)。
A.单位时间内生成n mol NO的向时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):u(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH3OH-O2燃料电池的工作原理如图所示。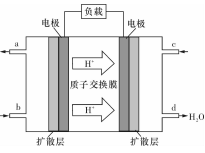
①该电池工作时,b口通入的物质为____ 。
②该电池正极的电极反应式为: 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图所示)的过程中,发现溶液逐渐变浑浊并有气泡产生,其原因可能是 (用相关的离子方程式表示)。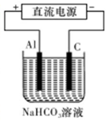
 4NO(g)+6 H2O(g)△H。
4NO(g)+6 H2O(g)△H。(1)已知氢气的燃烧热为285.8 kJ/mol。
N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ/mol;
H2O(1)=H2O(g)△H=+44.0 kJ/mol;
N2(g)+O2(g)=2NO(g)△H=+180.6 kJ/mol。
则上述工业制硝酸的主要反应的△H= 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:

①反应在第2 min到第4 min时,O2的平均反应速率为 。
②反应在第6 min时改变了条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)
 4NO(g)+6 H2 O(g)达到平衡状态的是 (填序号)。
4NO(g)+6 H2 O(g)达到平衡状态的是 (填序号)。A.单位时间内生成n mol NO的向时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):u(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH3OH-O2燃料电池的工作原理如图所示。

①该电池工作时,b口通入的物质为____ 。
②该电池正极的电极反应式为: 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图所示)的过程中,发现溶液逐渐变浑浊并有气泡产生,其原因可能是 (用相关的离子方程式表示)。


溶解铜屑一种方案是:将铜屑加入到稀硫酸与双氧水的混和液中并用30~40℃水浴加热,一段时间后,铜完全溶解,得到硫酸铜溶液.该反应的化学方程式为
(2)目前我国的火力发电机组绝大多数为燃煤机组,而以燃煤为主的电力生产所造成的环境污染是制约电力工业发展的一个重要因素,其中氮氧化物(NOx)是继粉尘和二氧化硫之后燃煤电站环保治理的重点.
①燃煤烟气脱硫的方法很多,如石灰石-石膏法、氨水法等.其中石灰石-石膏法脱硫的原理第一步是SO2+Ca(OH)2=CaSO3+H2O,然后再将产物氧化制成石膏,写出该反应的化学方程式
②燃煤烟气脱硝可采用氨(NH3)作为还原介质,在催化剂及氧气存在的条件下,氮氧化物(NOx)与还原剂发生反应,生成无害的氮气和水,写出二氧化氮与氨反应的化学方程式
