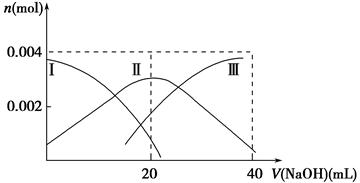
题目内容
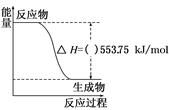
工业制硝酸的主要反应为:4NH3(g)+5O2(g)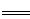 4NO(g)+6 H2O(g)△H。
4NO(g)+6 H2O(g)△H。
(1)已知氢气的燃烧热为285.8 kJ/mol。
N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ/mol;
H2O(1)=H2O(g)△H=+44.0 kJ/mol;
N2(g)+O2(g)=2NO(g)△H=+180.6 kJ/mol。
则上述工业制硝酸的主要反应的△H= 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表: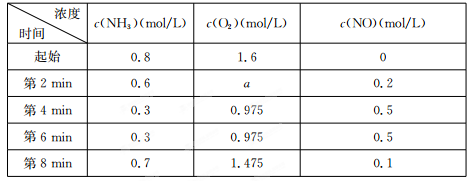
①反应在第2 min到第4 min时,O2的平均反应速率为 。
②反应在第6 min时改变了条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g) 4NO(g)+6 H2 O(g)达到平衡状态的是 (填序号)。
4NO(g)+6 H2 O(g)达到平衡状态的是 (填序号)。
A.单位时间内生成n mol NO的向时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):u(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
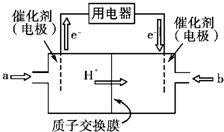
(3)某研究所组装的CH3OH-O2燃料电池的工作原理如图所示。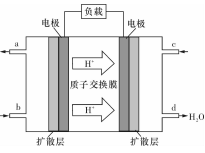
①该电池工作时,b口通入的物质为____ 。
②该电池正极的电极反应式为: 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图所示)的过程中,发现溶液逐渐变浑浊并有气泡产生,其原因可能是 (用相关的离子方程式表示)。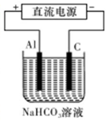
(1)-904.8kJ·mol-1 (2)①0.1875mol/(L·min) ②B ③ ABE
(3)①CH3OH ②O2+4e-+4H+=2H2O ③Al3++3HCO3-=Al(OH)3+3CO2(Al-3e-+3HCO3-Al(OH)3+3CO2也给分)
解析试题分析:(1)H2(g)+1/2O2(g)═H2O(l)△H=-285.8kJ·mol-1①
N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ/mol ②
H2O(1) H2O(g)△H=+44.0 kJ/mol ③
N2(g)+O2(g) 2NO(g)△H=+180.6 kJ/mol ④
根据盖斯定律,由方程式①×6-②×2③×6+④×2得工业制硝酸的主要反应为:4NH3(g)+5O2(g) 4NO(g)+6 H2O(g)△H=-904.8kJ·mol-1;
4NO(g)+6 H2O(g)△H=-904.8kJ·mol-1;
(2))①氨气的平均化学反应速率为v=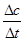 =
=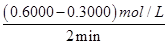 ="0.015" mol·L-1·min-1,同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以氧气的平均化学反应速率为0.1875mol·L-1·min-1;
="0.015" mol·L-1·min-1,同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以氧气的平均化学反应速率为0.1875mol·L-1·min-1;
②通过图表比较起始到第6min和第6min到第8min时知,反应物浓度变大和生成物浓度变小,逆向移动,所以改变的条件是升高温度;B正确,使用催化剂,平衡不移动,A错误;减小压强和增加O2的浓度,正向移动,CD错误;故答案为:B;
③A.单位时间内生成n mol NO的向时,生成n mol NH3,说明v正=v逆,A正确;
B.条件一定,混合气体的平均相对分子质量不再变化,方程式两边气体的化学计量数之和不相等,气体的物质的量是个变化的量,气体的质量始终不变,所以混合气体的平均相对分子质量不变,证明正逆反应速率相等,达到了平衡状态,B正确;
C.百分含量w(NH3)=w(NO),不能说明v正=v逆,C错误;
D.反应速率v(NH3):u(O2):v(NO):v(H2O)=4:5:4:6,不能说明v正=v逆,D错误;
E.由于反应方程式两边气体的质量不变,容器的容积不变,所以混合气体的密度可变,因此混合气体的密度是一个变量,可以判断是否达到了平衡状态,E正确;
(3)①在甲醇燃料电池中,燃料甲醇作负极,氧气作正极,电解质中的阳离子移向正极,所以c口通入的物质为氧气,b口通入的物质为甲醇; ②该电池正极是氧气发生得电子的还原反应,电极反应式为:O2+4e-+4H+=2H2O, ③在电解池中,金属铝为阳极,发生电极反应:Al→Al3++3e-,铝离子会和碳酸氢根离子之间发生双水解反应生成氢氧化铝沉淀和二氧化碳,即Al3++3HCO3-=Al(OH)3↓+3CO2↑,溶液逐渐变浑浊,故答案为:Al3++3HCO3-=Al(OH)3+3CO2(Al-3e-+3HCO3-=Al(OH)3+3CO2)。
考点:考查学生有关化学反应原理的综合题目。

乙醇是一种可燃性液体,按一定比例混合的乙醇汽油是一种新型清洁车用燃料,某科研机构研究利用CO2合成乙醇的方法:
(i)2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH1
CH3CH2OH(g)+3H2O(g) ΔH1
原料气氢气
(ii)CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH2
CO(g)+3H2(g) ΔH2
回答下列问题:
(1)使用乙醇汽油(汽油用戊烷代替)燃料时.气缸工作时进行的反应较多,写出燃烧产生有毒气体CO、NO的所有反应的化学方程式:________________________。
(2)反应(i)中能够提高氢气转化率的措施有____。
| A.增大压强 | B.加催化剂 | C.增大CO2的浓度 | D.及时分离体系中的乙醇 |
(iii)CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3写出以CO(g)与H2(g)为原料合成乙醇的热化学方程式:___________________(焓变用
 H1、
H1、 H3表示)。
H3表示)。(4)反应(ii)中的甲烷和水蒸气是在特定的催化剂表面上进行的,该反应在不同温度下的化学平衡常数如下表:
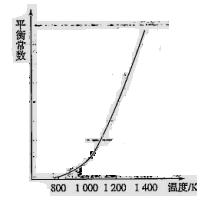
由此推知反应(ii)的焓变
 H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。
H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。(5)机动车在改用乙醇汽油后,并不能减少氮氧化物的排放。使用合适的催化剂可使NO转化为氮气,实验测得NO转化为氮气的转化率随温度变化曲线如下图所示:

由图像可知,在没有CO情况下,温度超过775K,NO的转化率减小,造成这种现象的原因可能是___________________________;在NO和CO物质的量之比为1:1的情况下,应控制的最佳温度为__________________左右。
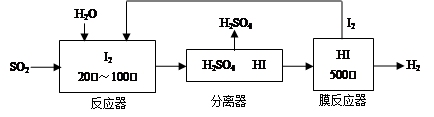
大气中的部分碘源于O3对海水中I-的氧化,将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)ΔH1
②IO-(aq)+H+(aq) HOI(aq)ΔH2
HOI(aq)ΔH2
③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l)ΔH3
I2(aq)+H2O(l)ΔH3
总反应的化学方程式为____________________,其反应热ΔH=__________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3—(aq),
I3—(aq),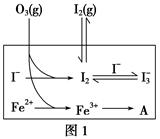
其平衡常数表达式为______________。
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3—浓度和体系pH,结果见图2和下表。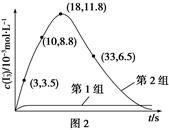 、
、
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
①第1组实验中,导致反应后pH升高的原因是______________________________。
②图1中的A为__________,由Fe3+生成A的过程能显著提高I-的转化率,原因是____________________________________________________________。
③第2组实验进行18 s后,I3—浓度下降,导致下降的直接原因有(双选)________(填字母序号)。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3—的平均反应速率(写出计算过程,结果保留两位有效数字)。
有效利用现有资源是解决能源问题的一种实际途径。发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程: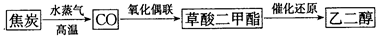
(1)该过程中产生的的CO可继续与水蒸气发生可逆反应得到CO2和H2,此反应的平衡常数表达式K=_____________。
(2)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,请写出CH3OH(l)燃烧热的热化学方程式_____________。
(3)“催化还原”反应制乙二醇原理如下: CH3OOC—COOCH3(g)+4H2(g) HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究。如图表示乙二醇达到平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线丙对应的压强是P(丙)=_____________。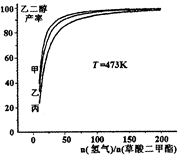
(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸①草酸氢钾溶液中存 在如下平衡: H2O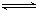 H++OH-、HC2O4-
H++OH-、HC2O4-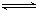 H++C2O42-和____________。
H++C2O42-和____________。
②向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液中各粒子浓度关系正确的是__________(填序号)。
| A.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-) |
| B.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-) |
| C.c(Na+)=c(H2C2O4)+c(C2O42-) |
| D.c(K+)>c(Na+) |
 CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。
CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。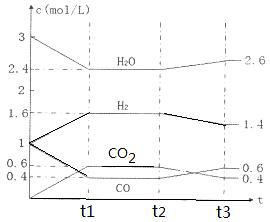
 TiCl4(l)ΔH="-804.2" kJ/mol
TiCl4(l)ΔH="-804.2" kJ/mol
 O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。