摘要:2.氨的结构和性质 N 分子式 电子式 结构式 表示式 H H H 特点 -3价为N最低价 有孤对电子 极性分子 Cat. 性质 有还原性 与H+等形成配位键 极易溶于水 △ 反应: 4NH3+5O2 4NO+6H2O 4NH3+3O2 2N2+6H2O 2NH3+3Cl2 = N2+6HCl NH3+H+=NH4+ NH3+HCl=NH4Cl NH3+H2O NH3·H2O NH+OH- HNO3=H++NO3- △ 冷 Fe3+ S +NO I2 M(NO3)n+NO 溶解Pt.Au 王水 溶于 Fe2+ S2- I- Zn.Mg等 较活泼金属 一般金属 稀HNO3 钝化 CO2.SO2.H3PO4 一般金属 Fe.Al C.S.P 存放 棕色瓶.冷暗处.密封 久置 黄 HNO3 氧化性 不稳定性 酸性 M(NO3)n+NO2 任意比 溶于水 或Fe(OH)2 3.硝酸 4HNO3 4NO2+O2+2H2O 无色 HNO3 有刺激性 易挥发 +浓HCl 浓HNO3 M(NO3)2+NO2(或N2 NH4NO3) O2
网址:http://m.1010jiajiao.com/timu3_id_357367[举报]
[化学--物质结构与性质]
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为
(2)NH3分子的空间构型是:
(3)NH3与PH3相比,热稳定性更强的是:
(4)一定压强,将NH3和PH3混合气体降温时,首先液化的物质是
(5)铜、铁元素能形成多种配合物.微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有
查看习题详情和答案>>
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
.在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为正四面体
正四面体
.在四大晶体类型中,GaN属于原子
原子
晶体.(2)NH3分子的空间构型是:
三角锥型
三角锥型
,中心原子N的杂化轨道类型是:sp3
sp3
.(3)NH3与PH3相比,热稳定性更强的是:
NH3
NH3
,理由是:氮的原子半径比磷的原子半径小,N-H键长比P-H键长短,键能更大,分子更稳定
氮的原子半径比磷的原子半径小,N-H键长比P-H键长短,键能更大,分子更稳定
.(4)一定压强,将NH3和PH3混合气体降温时,首先液化的物质是
NH3
NH3
,理由是:因为氨分子之间存在氢键,使分子间作用力更大,沸点更高
因为氨分子之间存在氢键,使分子间作用力更大,沸点更高
.(5)铜、铁元素能形成多种配合物.微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有
能够接受孤电子对的空轨道
能够接受孤电子对的空轨道
的原子或离子.从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质.

(1)下列说法正确的是 (填字母).
A.元素电负性由大到小的顺序为F>O>N
B.一个苯分子含3个π键和6个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Br>Se>As
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为 .光气(COCl2)各原子最外层都满足8电子稳定结构,COCl2分子空间构型为 (用文字描述).
(3)Cu 2+基态的电子排布式为 .向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为 ,不考虑空间构型,其内界结构可用示意图表示为 .
查看习题详情和答案>>
(12分)【化学——物质结构与性质】
氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是 。
| A.N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量 |
| B.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na |
| C.基态As原子中,电子占据的最高能级为4d |
| D.Bi原子中最外层有5个能量相同的电子 |
(3)PCl3分子中,Cl-P-Cl键的键角____ 109o28’(填“>”“<”或“=”)。
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。己知该晶体的密度为
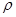 g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。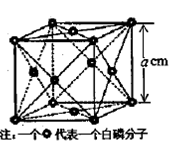 查看习题详情和答案>>
查看习题详情和答案>>
(12分)【化学——物质结构与性质】
氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是 。
(2)NH3在水中的溶解度比PH3大得多,其原因是 。向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有 和 。
(3)PCl3分子中,Cl-P-Cl键的键角____ 109o28’(填“>”“<”或“=”)。
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。己知该晶体的密度为 g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。

氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是 。
| A.N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量 |
| B.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na |
| C.基态As原子中,电子占据的最高能级为4d |
| D.Bi原子中最外层有5个能量相同的电子 |
(3)PCl3分子中,Cl-P-Cl键的键角____ 109o28’(填“>”“<”或“=”)。
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。己知该晶体的密度为
 g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
[化学——物质结构与性质]
I.氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是 。
a.N2可用于填充霓虹灯,其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道时以光的形式释放能量
b.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c.基态As原子中,电子占据的最高能级为4d
d.Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是 。
向硫酸铜溶液中先加过量氨水,后加适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体,
该晶体中不含有的化学键是 。
Ⅱ. 第四周期金属与人类的生产生活息息相关。
(3)目前市售的发光二极管,其材质以砷化镓(GaAs) 为主。已知镓是与铝同族,镓的基态原子的电子排布式是 。GaAs中Ga的化合价为 。
(4)金属钛坚硬、强度大、耐热、密度小,被称为高技术金属。TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟, 则TiCl4属于 (填“原子”“分子”或“离子”)晶体。
(5) 钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种的化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,产生白色沉淀; 往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时, 产生淡黄色沉淀,则第二种配合物的化学式为 。
I.氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是 。
a.N2可用于填充霓虹灯,其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道时以光的形式释放能量
b.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c.基态As原子中,电子占据的最高能级为4d
d.Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是 。
向硫酸铜溶液中先加过量氨水,后加适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体,
该晶体中不含有的化学键是 。
| A.极性键 | B.非极性键 | C.离子键 | D.配位键 E.氢键 |
(3)目前市售的发光二极管,其材质以砷化镓(GaAs) 为主。已知镓是与铝同族,镓的基态原子的电子排布式是 。GaAs中Ga的化合价为 。
(4)金属钛坚硬、强度大、耐热、密度小,被称为高技术金属。TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟, 则TiCl4属于 (填“原子”“分子”或“离子”)晶体。
(5) 钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种的化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,产生白色沉淀; 往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时, 产生淡黄色沉淀,则第二种配合物的化学式为 。