摘要:1]9 A.D 20 C 21 A 22 D 23 A 24 D 25 C 26 C 27 B.D 28 B 29 B 30 2+C2H2↑ (2)装置Ⅰ需要用水封住漏斗的下端才可检验 (3)除去乙炔中的H2S等杂质气体 H2S+Cu2+=CuS↓+2H+ 注:用FeCl3.NaOH等均可. (4)饱和食盐水 反应发生后.水量减少.使食盐晶体附着在CaC2表面.减弱其与水的接触. (5)①部分乙炔气体会从漏斗口逸出造成实验误差,②用长颈漏斗不易控制加水量 (6)①选择块状电石,②在导管口加上一团棉花 (7)不能 反应太剧烈.不便于控制.且该反应系放热反应.易使启普发生器炸裂.同时.生成的Ca(OH)2系糊状物.易堵塞球形漏斗下端 (8)32b/13a×100% 31 32 94.7 (3)12 33 36/37 (3)减少 34 ① ②
网址:http://m.1010jiajiao.com/timu3_id_357159[举报]
生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
(1)甲醛溶液可用于浸制生物标本,这主要是利用了甲醛的何种化学性质 .
(2)由生物质能获得的CO和H2,可以合成多种有机物.当CO和H2以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是 .
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得
反应达到平衡时的有关数据如下:
下列说法正确的是 .
A.cl=c2 B.2Q1=Q3 C.KI=K3 D.a2+a3<100%
(4)一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2 (g)+3CO (g) CH3OCH3 (g)+CO2(g)
若一体积可变的密闭容器中充入3mol H2、3molCO、l mol CH3OCH3、l mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍.平衡时
n(CH3OCH3)= mol.反应开始时正、逆反应速率的大小:v(正) v(逆)(填‘‘>’’、“<”或“=”),理由是 .
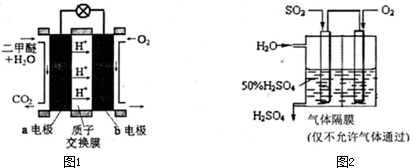
(5)如图1为绿色电源“直接二甲醚燃料电池”的工作原理示意图.b电极是 极,a电极的反应式为 .
(6)利用生物质资源过程中会产生SO2,可利用如图2所示装置,用电化学原理生产硫酸为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为 .
查看习题详情和答案>>
(1)甲醛溶液可用于浸制生物标本,这主要是利用了甲醛的何种化学性质
(2)由生物质能获得的CO和H2,可以合成多种有机物.当CO和H2以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得
反应达到平衡时的有关数据如下:
| 1.容器 | 2.甲 | 3.乙 | 4.丙 |
| 5.反应物投入量 | 6.1molCO、2molH2 | 7.l molCH3OH | 8.2molCO、4molH2 |
| 9.CH30H昀浓度(mol/L) | 10.cl | 11.c2 | 12.c3 |
| 13.反应的能量变化 | 14.放出Q1kJ | 15.吸收Q2kJ | 16.放出Q3kJ |
| 17.平衡常数 | 18.Kl | 19.K2 | 20.K3 |
| 21.反应物转化率 | 22.al | 23.a2 | 24.a3 |
A.cl=c2 B.2Q1=Q3 C.KI=K3 D.a2+a3<100%
(4)一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2 (g)+3CO (g) CH3OCH3 (g)+CO2(g)
若一体积可变的密闭容器中充入3mol H2、3molCO、l mol CH3OCH3、l mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍.平衡时
n(CH3OCH3)=

(5)如图1为绿色电源“直接二甲醚燃料电池”的工作原理示意图.b电极是
(6)利用生物质资源过程中会产生SO2,可利用如图2所示装置,用电化学原理生产硫酸为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为