摘要: 在4.40克乙酸乙酯中加入0.25摩/升的稀硫酸100毫升.加热使其水解.然后用水稀释到1升.取出其中的25毫升.用0.1摩/升的苛性钠溶液中和.当滴至15毫升时.恰好与其中的酸完全反应.求乙酸乙酯的水解百分率.
网址:http://m.1010jiajiao.com/timu3_id_357044[举报]
将4.5克乙酸和乙二酸(HOOC—COOH)混合物溶于水,恰好跟2摩/升氢氧化钠溶液45毫升完全中和,则混合物中乙酸的百分含量是 ( )
A.80% B.60% C.40% D.20%
查看习题详情和答案>>
乙酸乙酯是重要的工业原料和溶剂.现利用如图装置制取乙酸乙酯的粗产品,再测定乙酸乙酯的含量.

(1)写出反应方程式________(反应)
(2)实验室一般用饱和碳酸钠溶液接收反应的生成物.若不振荡该试管,可看到的现象是________,若振荡该试管,可看到的现象是________,但是有却出现了白色晶体,该晶体是________;
(3)对于制乙酸乙酯的上述装置,为了提高产率,请提出一条改进意见:
________.
(4)为测定乙酸乙酯的含量,进行如下操作:
(Ⅰ)准确称量20.0 g乙酯乙酯粗品于锥形瓶中,用0.50 mol/L NaOH滴定(酚酞做示剂).终点时消耗NaOH溶液的体积为40.0 mL
(Ⅱ)另取20.0 g乙酸乙酸粗产品于250 mL锥形瓶中,加入100 mL的2.1 mol/L NaOH溶液混合增色匀后,装上冷凝管,在水浴上加热回流约1小时,装置如图所示.待冷却后,用0.50 mol/LHC1滴定过量的NaOH.终点时消耗盐酸的体积为20.0 mL.
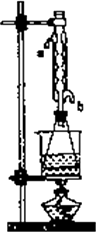
回答:①实验(Ⅰ)中达到滴定终点时的现象是________.
②实验(Ⅱ)中冷水从冷水凝管的________(填a或b)管口通入.
③利用实验(Ⅰ)、(Ⅱ)测量的数据计算粗产物中乙酸乙酯的质量分数为________.
写出下列有机反应的化学方程式
(1)乙烯加聚成聚乙烯
 ;
;
(2)乙醛被银氨溶液氧化
(3)向苯酚钠溶液中通入少量的CO2
(4)制取乙酸乙酯
(5)乙醇在铜丝或银丝催化下氧化成乙醛
查看习题详情和答案>>
(1)乙烯加聚成聚乙烯


(2)乙醛被银氨溶液氧化
CH3CHO+2Ag(NH3)2OH
CH3COONH4+2Ag+3NH3+H2O
| △ |
CH3CHO+2Ag(NH3)2OH
CH3COONH4+2Ag+3NH3+H2O
;| △ |
(3)向苯酚钠溶液中通入少量的CO2
C6H5ONa+CO2+H2O→C6H6OH+NaHCO3
C6H5ONa+CO2+H2O→C6H6OH+NaHCO3
;(4)制取乙酸乙酯
CH3COOH+C2H5OH
CH3COOC2H5+H2O
| 浓硫酸 |
| △ |
CH3COOH+C2H5OH
CH3COOC2H5+H2O
;| 浓硫酸 |
| △ |
(5)乙醇在铜丝或银丝催化下氧化成乙醛
2CH3CH2OH+O2
2CH3CHO+2H2O
| Cu或Ag |
| △ |
2CH3CH2OH+O2
2CH3CHO+2H2O
.| Cu或Ag |
| △ |
 实验室可以用右图所示的装置制取乙酸乙酯.回答下列问题:
实验室可以用右图所示的装置制取乙酸乙酯.回答下列问题:(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:
先在试管中加入一定量的乙醇,然后边加边振荡试管将浓硫酸慢慢加入试管,最后再加入乙酸
先在试管中加入一定量的乙醇,然后边加边振荡试管将浓硫酸慢慢加入试管,最后再加入乙酸
(2)饱和碳酸钠溶液的主要作用是
中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度
中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度
(3)若要把制得的乙酸乙酯分离出来,应采用的实验操作是
分液
分液
.(4)生成乙酸乙酯的反应是可逆反应,反应一段时间后,就达到了该反应的限度.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)
①③
①③
.①混合物中各物质的浓度不再变化;②单位时间里,生成1mol乙醇,同时生成1mol乙酸;③单位时间里,生成1mol乙酸乙酯,同时生成1mol.