网址:http://m.1010jiajiao.com/timu3_id_35683[举报]
(2)在恒温、恒压和使用催化剂的条件下,已知:在容积可变的密闭容器中,充入含3molH2和1molN2混合气体,反应达平衡时有a molNH3生成,N2的转化率为b%.若仍在恒温、恒压和使用催化剂的条件下,在体积可变的密闭容器中充入x molH2和y molN2,反应达平衡时有3a molNH3生成,N2的转化率仍为b%.则x=
DME(二甲醚、CH3OCH3)是一种重要的清洁能源,可作为柴油的理想替代燃料和民用燃料,被誉为“二十一世纪的新能源”。另外,二甲醚还被广泛用作致冷剂、气雾剂以及有机化工中间体。
(1)工业上一步法制二甲醚的生产流程如下:
工业制备二甲醚(CH3OCH3)在催化反应室中(压强2.0-10.0Mpa,温度230-2800C)进行下列反应:
Ⅰ.CO(g)+2H2(g) CH3OH(g) △H = —90.7kJ·mol—1
CH3OH(g) △H = —90.7kJ·mol—1
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g)△H = —23.5kJ·mol—1
CH3OCH3(g)+H2O(g)△H = —23.5kJ·mol—1
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g)△H = —41.2kJ·mol—1
CO2(g)+H2(g)△H = —41.2kJ·mol—1
①反应器中总反应式可表示为:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),则该反应的△H =
CH3OCH3(g)+CO2(g),则该反应的△H =
②下列有关反应Ⅲ的说法正确的是
A.在体积可变的密闭容器中,在反应Ⅲ达到平衡后,若加压,则平衡不移动、混合气体平均相对分子质量不变、混合气体密度不变。
B.某温度下,若向已达到平衡的的反应Ⅲ中加入等物质的量的CO和H2O,则平衡右移、平衡常数变大
C. 若830℃时反应③的K=1,则在催化反应室中反应Ⅲ的K>1.0
(2)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。A.容器中密度不变 B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
CH3OCH3(g)+3H2O(g)△H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。A.容器中密度不变 B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2)︰v(H2)=1︰3 D.容器内压强保持不变
(3)二甲醚也可以通过CH3OH分子间脱水制得
在 ,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
①该条件下反应平衡常数表达式K=______根据图中数据计算 时该反应的平衡常数为
时该反应的平衡常数为
②相同条件下,若改变起始浓度,某时刻各组分浓度依次为: 、
、 此时正、逆反应速率的大小:
此时正、逆反应速率的大小: _______
_______ (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。
(4)下图为二甲醚燃料电池的工作原理示意图。
请回答下列问题:
①A电极是 极。
②B电极上发生的电极反应式是 。
DME(二甲醚、CH3OCH3)是一种重要的清洁能源,可作为柴油的理想替代燃料和民用燃料,被誉为“二十一世纪的新能源”。另外,二甲醚还被广泛用作致冷剂、气雾剂以及有机化工中间体。
(1)工业上一步法制二甲醚的生产流程如下:
工业制备二甲醚(CH3OCH3)在催化反应室中(压强2.0-10.0Mpa,温度230-2800C)进行下列反应:
Ⅰ.CO(g)+2H2(g) CH3OH(g) △H =—90.7kJ·mol—1
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g) △H =—23.5kJ·mol—1
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g) △H = —41.2kJ·mol—1
①反应器中总反应式可表示为:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),则该反应的△H=
②下列有关反应Ⅲ的说法正确的是
A.在体积可变的密闭容器中,在反应Ⅲ达到平衡后,若加压,则平衡不移动、混合气体平均相对分子质量不变、混合气体密度不变。
B.某温度下,若向已达到平衡的的反应Ⅲ中加入等物质的量的CO和H2O,则平衡右移、平衡常数变大
C. 若830℃时反应③的K=1,则在催化反应室中反应Ⅲ的K>1.0
(2)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。A.容器中密度不变 B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2)︰v(H2)=1︰3 D.容器内压强保持不变
(3) 二甲醚也可以通过CH3OH分子间脱水制得
在,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
①该条件下反应平衡常数表达式K=______根据图中数据计算时该反应的平衡常数为
②相同条件下,若改变起始浓度,某时刻各组分浓度依次为:
、
此时正、逆反应速率的大小:
_______
(填“>”、“<”、或“=”)。
(4)下图为二甲醚燃料电池的工作原理示意图。
请回答下列问题:
①A电极是 极。
②B电极上发生的电极反应式是 。
查看习题详情和答案>>
2013年雾霾天气多次肆虐我国中东部地区。其中汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作KP),则该反应的KP=-???????????????? 。
②该反应在低温下能自发进行,该反应的ΔH ????????? 0。(选填“>”、“<”)
③在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2 --tl=t3-t2)。

则下列说法不正确的是????????? 。(填编号)
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:tl~t2>t2~t3
(2)煤的综合利用、使用清洁能源等有利于减少环境污染。合成氨工业原料气的来源之一水煤气法,在催化剂存在条件下有下列反应:
①
②
③
①△H3和△H1、△H2的关系为△H3=???????????? 。
②在恒温条件下,将l mol CO和1 mol H2O(g)充入某固定容积的反应容器,达到平衡时有50%的CO转化为CO2。在tl时保持温度不变,再充入1 mol H2O(g),请在图中画出tl时刻后H2的体积分数变化趋势曲线。

③甲醇汽油可’以减少汽车尾气对环境的污染。
某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)  CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L,现往容器中继续通人3 mol CO,此时v(正)??????? ? v(逆)(选填‘‘>”、“<’’或“=”),判断的理由??????? 。
CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L,现往容器中继续通人3 mol CO,此时v(正)??????? ? v(逆)(选填‘‘>”、“<’’或“=”),判断的理由??????? 。
查看习题详情和答案>>
DME(二甲醚、CH3OCH3)是一种重要的清洁能源,可作为柴油的理想替代燃料和民用燃料,被誉为“二十一世纪的新能源”。另外,二甲醚还被广泛用作致冷剂、气雾剂以及有机化工中间体。
(1)工业上一步法制二甲醚的生产流程如下:
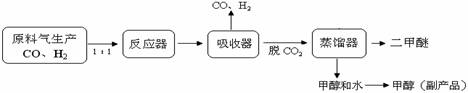
工业制备二甲醚(CH3OCH3)在催化反应室中(压强2.0-10.0Mpa,温度230-2800C)进行下列反应:
Ⅰ.CO(g)+2H2(g) CH3OH(g) △H =
—90.7kJ·mol—1
CH3OH(g) △H =
—90.7kJ·mol—1
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g) △H =
—23.5kJ·mol—1
CH3OCH3(g)+H2O(g) △H =
—23.5kJ·mol—1
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g) △H = —41.2kJ·mol—1
CO2(g)+H2(g) △H = —41.2kJ·mol—1
①反应器中总反应式可表示为:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),则该反应的△H
=
CH3OCH3(g)+CO2(g),则该反应的△H
=
②下列有关反应Ⅲ的说法正确的是
A.在体积可变的密闭容器中,在反应Ⅲ达到平衡后,若加压,则平衡不移动、混合气体平均相对分子质量不变、混合气体密度不变。
B.某温度下,若向已达到平衡的的反应Ⅲ中加入等物质的量的CO和H2O,则平衡右移、平衡常数变大
C. 若830℃时反应③的K=1,则在催化反应室中反应Ⅲ的K>1.0
(2)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。A.容器中密度不变
B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
CH3OCH3(g)+3H2O(g) △H>0。判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。A.容器中密度不变
B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2)︰v(H2)=1︰3 D.容器内压强保持不变
(3) 二甲醚也可以通过CH3OH分子间脱水制得

在 ,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。

①该条件下反应平衡常数表达式K=______根据图中数据计算 时该反应的平衡常数为
时该反应的平衡常数为
②相同条件下,若改变起始浓度,某时刻各组分浓度依次为:
 、
、 此时正、逆反应速率的大小:
此时正、逆反应速率的大小: _______
_______ (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。
(4)下图为二甲醚燃料电池的工作原理示意图。

请回答下列问题:
①A电极是 极。
②B电极上发生的电极反应式是 。
查看习题详情和答案>>