摘要:一定条件下反应:A2(气)+B2(气) 2AB(气)达到化学平衡状态的标志是 A.单位时间内生成n mol A.同时消耗2n mol AB B.容器内压强不随时间变化而变化 C.混合气体密度不随时间变化而变化 D.单位时间内生成2n mol AB.同时生成n mol B
网址:http://m.1010jiajiao.com/timu3_id_356663[举报]
 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:已知一个B分子中含有的Z元素的原子个数比C分子中的少一个.
请回答下列问题:
(1)X元素在周期表中的位置是
第2周期,ⅥA族
第2周期,ⅥA族
.(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入
氧气
氧气
(填物质名称);负极电极反应式为H2+2OH-=2H2O+2e-
H2+2OH-=2H2O+2e-
.(3)C在一定条件下反应生成A的化学方程式是
4NH3+5O2 4NO+6H2O
4NO+6H2O
 4NO+6H2O
4NO+6H2O4NH3+5O2 4NO+6H2O
4NO+6H2O
. 4NO+6H2O
4NO+6H2O(4)已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0.将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应.下列说法中,正确的是
ab
ab
(填写下列各项的序号).a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
e.达到化学平衡后,再升高温度,C的体积分数增大.
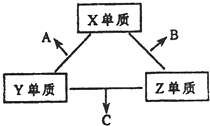 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
(1)X元素在周期表中的位置是
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在
(3)①C在一定条件下反应生成A的化学方程式是
②X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐.该盐的水溶液pH<7,其原因是(写出离子方程式)
 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
(1)X元素在周期表中的位置是
第2周期VIA族
第2周期VIA族
.(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在
氢键
氢键
.(3)①C在一定条件下反应生成A的化学方程式是
4NH3+5O2=4NO+6H2O
4NH3+5O2=4NO+6H2O
.②X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐.该盐的水溶液pH
小于
小于
7(填“大于”、“小于”、“等于”),其原因是(写出离子方程式)NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+(4)已知Y单质与Z单质生成C的反应是可逆反应,△H<0.将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应.下列说法正确的有
ad
ad
.a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中气体平均相对分子质量减小
e.达到化学平衡后,升高温度,C的体积分数增大.
一定温度下,向一容积为2L的恒容密闭容器中充入2molA与3molB,在一定条件下反应:A(g)+3B(g)?xC(g)+yD(g) (x、y为正整数),反应进行2min后达到平衡,已知2min内用C物质的浓度变化量表示的平均反应速率v(C)=0.3mol/(L?min),D的平衡浓度为0.3mol/L,又知反应速率v(B):v(C)=3:2,试计算:
(1)x、y的值分别是
(2)平衡时反应物A的转化率
(3)平衡常数K=
(可以用分数表示)
查看习题详情和答案>>
(1)x、y的值分别是
2
2
和1
1
(2)平衡时反应物A的转化率
30%
30%
(3)平衡常数K=
| 5 |
| 7 |
| 5 |
| 7 |
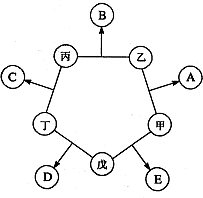 甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图所示:又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是日常生活中一种常见的金属.
甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图所示:又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是日常生活中一种常见的金属.②乙在甲中燃烧发出苍白色火焰,戊在甲中燃烧生成棕黄色烟,E的水溶液呈黄色.
③常温下B、C均为无色气体,D为磁性黑色固体.
(1)D的化学式
(2)把戊加入到E的水溶液中,写出该反应的离子方程式
(3)工业上可由B与丁反应制取C,写出该反应的化学方程式
(4)将氯气和E同时加(通)入强碱性溶液中,可制得一种高效杀菌、净水剂(其中含由+6价戊元素形成的带2个单位负电荷的含氧酸根离子),请写出该反应的离子方程式