摘要:34.如右图所示.两根相距为l的平行直导轨ab.cd.b.d间连有一固定电阻R.导轨电阻可忽略不计.MN为放在ab和cd上的一导体杆.与ab垂直.其电阻也为R.整个装置处于匀强磁场中.磁感应强度的大小为B.磁场方向垂直于导轨所在平面.现对MN施力使它沿导轨方向以速度v做匀速运动.令U表示MN两端电压的大小.则 A 流过固定电阻R的感应电流由b到d B 流过固定电阻R的感应电流由d到b C 流过固定电阻R的感应电流由b到d D 流过固定电阻R的感应电流由d到b
网址:http://m.1010jiajiao.com/timu3_id_35665[举报]
 如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol?L-1,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述中不正确的是( )
如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol?L-1,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述中不正确的是( )
查看习题详情和答案>>
 (2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:
(2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:| 元素编号 | 相关信息比 |
| U | 所处的周期数、族序数分别与其原子序数相等 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
| W | 基态时,2p 轨道处于半充满状态 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离 |
| Y | 是第四周期元素中未成对电子数最多的元素 |
| Z | Z 的一种核素的质量数为65,中子数为 36 |
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为
5:1
5:1
,其中心原子采取sp2
sp2
杂化;(2)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中含
共价
共价
键,属于原子
原子
晶体;(3)Y 的基态原子的核外电子排布式为
[Ar]3d54s1
[Ar]3d54s1
;(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有 18 个电子.乙和丙的化学式分别是
C2H6
C2H6
、H2O2
H2O2
,两者沸点的关系为乙<
<
丙(填“>”或“<”),原因是H2O2分子见存在氢键,C2H6分子间不存在氢键
H2O2分子见存在氢键,C2H6分子间不存在氢键
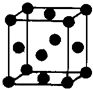
;(5)Z单质晶体的晶胞如右图所示,其配位数为:
12
12
.X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题:
(1)U单质的原子堆积方式为
(2)X的一种氢化物的相对分子质量为28,其分子中σ键与π键的键数之比为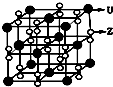
(3)化合物甲由Z、U两元素组成,其晶胞如右图所示.
①甲的化学式为
②下列有关该晶体的说法中正确的是
A.每个晶胞中含有14个U+和13个Z2-
B.晶体中每个U+周围距离U+最近的Z2-有6个
C.该晶体属于离子晶体
③甲的密度为a g?cm-3,则晶胞的体积是
cm3(只要求列出计算式,阿伏加德罗常数用NA表示).
查看习题详情和答案>>
(1)U单质的原子堆积方式为
体心立方堆积
体心立方堆积
,Y的简单氢化物分子式为NH3
NH3
.(2)X的一种氢化物的相对分子质量为28,其分子中σ键与π键的键数之比为
5:1
5:1
.
(3)化合物甲由Z、U两元素组成,其晶胞如右图所示.
①甲的化学式为
KO2
KO2
.②下列有关该晶体的说法中正确的是
BC
BC
(选填选项字母).A.每个晶胞中含有14个U+和13个Z2-
B.晶体中每个U+周围距离U+最近的Z2-有6个
C.该晶体属于离子晶体
③甲的密度为a g?cm-3,则晶胞的体积是
| 284 |
| aNA |
| 284 |
| aNA |
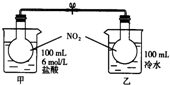 如右图所示,两烧瓶中充入NO2气体,存在如下平衡:2NO2(g)?N2O4(g)△H<0;烧杯甲中盛放100mL 6mol?L-1的HCl溶液,烧杯乙中盛放100mL冷水,现向烧杯甲的溶液中放入25g NaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解.
如右图所示,两烧瓶中充入NO2气体,存在如下平衡:2NO2(g)?N2O4(g)△H<0;烧杯甲中盛放100mL 6mol?L-1的HCl溶液,烧杯乙中盛放100mL冷水,现向烧杯甲的溶液中放入25g NaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解.(1)A瓶中气体颜色
加深
加深
;简述理由NaOH溶于水以及与NaOH与HCl的反应都是放热反应,所以烧杯甲的溶液的温度升高,温度升高,平衡2NO2(g)?N2O4(g)△H<0向吸热方向移动,即逆反应方向移动,NO2浓度增大,颜色加深,
NaOH溶于水以及与NaOH与HCl的反应都是放热反应,所以烧杯甲的溶液的温度升高,温度升高,平衡2NO2(g)?N2O4(g)△H<0向吸热方向移动,即逆反应方向移动,NO2浓度增大,颜色加深,
.(2)B瓶中气体颜色
变浅
变浅
;简述理由NH4NO3溶于水是吸热的,使体系温度降低,使平衡2NO2(g)?N2O4(g)△H<0 向放热热方向移动,即反应方向移动,NO2浓度减小,颜色变浅.
NH4NO3溶于水是吸热的,使体系温度降低,使平衡2NO2(g)?N2O4(g)△H<0 向放热热方向移动,即反应方向移动,NO2浓度减小,颜色变浅.
.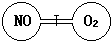 如右图所示,两个连通容器用活塞分开,左右两室各充入一定量NO和O2,且恰好使两容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来( )
如右图所示,两个连通容器用活塞分开,左右两室各充入一定量NO和O2,且恰好使两容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来( )