摘要:13.某短周期金属元素M的碳酸的正盐与其酸式盐的混合物中.二者的物质的量之比为2:3.取一定量的混合物与足量的盐酸反应.消耗的H+与产生的CO2的物质的量之比为5:4.则下列叙述中正确的是( ) A.该金属可能为ⅡA族元素 B.若该金属为第三周期元素.则对应的单质能够与CO2反应 C.若该金属为第三周期元素.则氧化物化学式可能为M2O2或M2O D.若该金属为第三周期元素.则对应的碳酸的正盐的稳定性比Na2CO3强
网址:http://m.1010jiajiao.com/timu3_id_35582[举报]
(2013?烟台模拟)【化学物质结构与性质】
开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti3+的未成对电子有
②LiBH4由Li+和BH-4构成,BH-4呈四面体构型.LiBH4中不存在的作用力有
a.离子键 b.共价键℃.金属键 d.配位键.
③Li、B、H元素的电负性由大到小排列顺序为
(2)佥属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如表所示:
M是
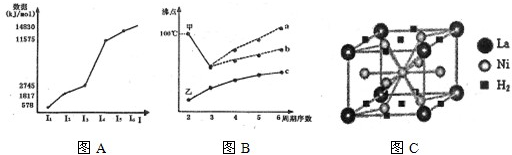
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示.该合金的化学式为
查看习题详情和答案>>
开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti3+的未成对电子有
1
1
个.②LiBH4由Li+和BH-4构成,BH-4呈四面体构型.LiBH4中不存在的作用力有
c
c
(填标号)a.离子键 b.共价键℃.金属键 d.配位键.
③Li、B、H元素的电负性由大到小排列顺序为
H>B>Li
H>B>Li
.(2)佥属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+
<
<
H-(填“>”、“=”或“<”).②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如表所示:

| I1/kJ?mol-1 | I2/kJ?mol-1 |
I3/kJ?mol-1 |
I4/kJ?mol-1 |
I5/kJ?mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
Mg
Mg
(填元素符号).(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示.该合金的化学式为
LaNi5
LaNi5
.开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4—构成,BH4—呈正四面体构型。LiBH4中不存在的作用力有______(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
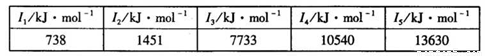
M是______(填元素符号)。
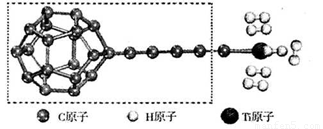
(3)某种新型储氢材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有______种。
(4)分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是______(填标号)。
A.H2O B.CH4 C.HF D.CO(NH2)2
查看习题详情和答案>>
(1)①图A是某短周期元素M的部分电离能变化情况.M元素位于周期表的第
②图B是部分同主族元素氢化物沸点的变化规律图象.不同同学对某主族元素氢化物沸点的变化趋势画出了两条折线a和b,正确的是
③甲、乙两种氢化物分子中,中心原子的轨道杂化方式相同,其杂化方式为
(2)氢气是新型清洁能源,镧(La)和镍 (Ni)的合金可做储氢材料.图C是一种镍镧合金储氢后的晶胞结构图.
①Ni原子的价电子排布式是
②该合金储氢后,含1mol La的合金可吸附H2的物质的量为
查看习题详情和答案>>
ⅡA
ⅡA
族.②图B是部分同主族元素氢化物沸点的变化规律图象.不同同学对某主族元素氢化物沸点的变化趋势画出了两条折线a和b,正确的是
b
b
(填“a”或“b”),理由是甲点所示的氢化物是水,其沸点高是由于在水分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,所以氧族元素中其它氢化物的沸点不会高于水
甲点所示的氢化物是水,其沸点高是由于在水分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,所以氧族元素中其它氢化物的沸点不会高于水
.③甲、乙两种氢化物分子中,中心原子的轨道杂化方式相同,其杂化方式为
sp3
sp3
,但甲、乙两分子的立体结构不同,原因是水含有2个孤电子对,电子对互斥,为V形
水含有2个孤电子对,电子对互斥,为V形
.(2)氢气是新型清洁能源,镧(La)和镍 (Ni)的合金可做储氢材料.图C是一种镍镧合金储氢后的晶胞结构图.
①Ni原子的价电子排布式是
3d84s2
3d84s2
.②该合金储氢后,含1mol La的合金可吸附H2的物质的量为
3mol
3mol
.