摘要:3.记住水的物理性质和水发生分解反应的化学性质.通过电解水的实验明确水的组成.
网址:http://m.1010jiajiao.com/timu3_id_355134[举报]
完全电解19g含有重水(D2O)的普通水时,共产生气体33.6L(标准状况),下列说法正确的是
A、所得气体的质量为18g
B、该水的物理性质和普通水完全相同
C、电解前H2O和D2O的物质的量之比是11
D、如果得到的氢气只有H2和D2两种,则它们的质量之比是11
查看习题详情和答案>>(2011?下城区模拟)乙酰乙酸乙酯(CH3COCH2COOC2H5)是一种不溶于水的液体,熔点:-45°C,沸点:180.8℃,它是有机合成中常用的原料.在实验室,它可以由乙酸乙酯在乙醇钠的催化作用下缩合而制得,反应式为:
2CH3COOC2H5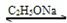 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH
反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙酸钠.乙酰乙酸乙酯制备的流程如下:
金属钠,有机液体
钠熔化
小米状钠珠
橘红色溶液
含乙酰乙酸乙酯的混合物
乙酰乙酸乙酯粗产品
阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题.
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
最好选用
理由是
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管.缓缓加热,保持瓶中混合液微沸状态.在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是
烧瓶配上长导管的作用是
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品.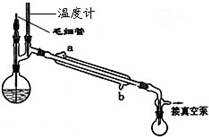
粗产品
乙酰乙酸乙酯
(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示.
冷凝管的进出水方向应
(6)实验最后所得产品远少于完全转化的理论产值,除了反应过程中的损耗外,主要原因是
查看习题详情和答案>>
2CH3COOC2H5
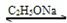 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙酸钠.乙酰乙酸乙酯制备的流程如下:
金属钠,有机液体
| 回流 |
| 振荡② |
| 回收有机液体③ |
| 加入乙酸乙酯④ |
| 乙酸酸化⑤ |
| ⑥ |
| ⑦ |
阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题.
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138.4 | 76.8 |
对二甲苯
对二甲苯
来熔化钠.是否能用四氯化碳?否
否
(填“是”或“否”)理由是
四氯化碳的沸点比钠的熔点低
四氯化碳的沸点比钠的熔点低
.(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管.缓缓加热,保持瓶中混合液微沸状态.在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是
有水则钠和水反应生成NaOH,使乙酸乙酯水解
有水则钠和水反应生成NaOH,使乙酸乙酯水解
,烧瓶配上长导管的作用是
导气及冷凝回流
导气及冷凝回流
,导管上端接一干燥管的目的是防止空气中的水蒸气进入烧瓶
防止空气中的水蒸气进入烧瓶
.(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是
使乙酰乙酸乙酯分层析出(分层)
使乙酰乙酸乙酯分层析出(分层)
,写出步骤⑦实验操作的主要仪器分液漏斗
分液漏斗
(填最主要一种).粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品.

粗产品
| 无水硫酸钠 |
| 过滤 |
| 水浴蒸馏 |
| 减压蒸馏 |
(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是
干燥水分
干燥水分
.(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示.
冷凝管的进出水方向应
b
b
口进,a
a
口出.毛细管的作用是平衡压强、提供汽化中心、防暴沸
平衡压强、提供汽化中心、防暴沸
.(6)实验最后所得产品远少于完全转化的理论产值,除了反应过程中的损耗外,主要原因是
反应是可逆反应,只能部分转化
反应是可逆反应,只能部分转化
.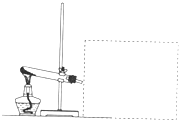 看图回答下列问题(部分仪器已被虚线遮挡,且虚线部分仪器可以根据需要添加)
看图回答下列问题(部分仪器已被虚线遮挡,且虚线部分仪器可以根据需要添加)(1)如果在虚线部分增加收集装置,上图中装置可用于实验室制取氨气,请回答以下问题:
①可以用
瓶口向下排空气法
瓶口向下排空气法
方法收集氨气,如果用烧瓶收集氨气,请用文字叙述如何检验氨气己收集满用湿润的红色石蕊试纸靠近瓶口,试纸变蓝,说明已收集满
用湿润的红色石蕊试纸靠近瓶口,试纸变蓝,说明已收集满
;②利用①中收集的氨气可以完成喷泉实验,是因为氨气具有
极易溶于水
极易溶于水
的物理性质;③写出实验室制氨气的化学反应方程式
2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O
2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O
;(2)上图装置还可以用于完成某些固体物质受热分解的实验.请回答:
①Na2CO3和NaHCO3这两种物质中有一种可以用上图装置进行受热分解的实验.该物质受热分解的化学反应方程式为:
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
;
| ||
②为了验证①中该物质受热分解产生的所有气体产物,在虚线处应连接(表述时请指明使用仪器,仪器中盛装的试剂和仪器的连接顺序)
先连接装有白色无水硫酸铜固体的干燥管,再连接装有澄清石灰水的烧杯
先连接装有白色无水硫酸铜固体的干燥管,再连接装有澄清石灰水的烧杯
;③请提出一点有关实验过程中安全问题的建议:
反应后先撤导气管,再撤酒精灯
反应后先撤导气管,再撤酒精灯
;④如果将12.6g的该物质加热分解,加热一段时间后,测得剩余固体质量为9.5g,则已经分解的该物质的质量为
8.4
8.4
g.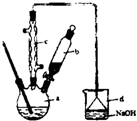 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:步骤1:在a中(装置如右下图所示)加入15mL无水的苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水8mL 10%的NaOH溶液,10mL水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙、静置、过滤即得粗产品.
| 苯 | 溴 | 溴苯 | |
| 密度/gcm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中的溶解度 | 微溶 | 微溶 | 微溶 |
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是
(3)仪器c的作用是冷凝回流,回流的主要物质有
(4)步骤3中第一次用10mL水洗涤的主要操作步骤为
(5)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如左上表,则要进一步提纯粗产品,还必须进行的实验操作名称是
(6)若步骤4的粗产品经进一步精制得到6.5mL的溴苯.则该实验中溴苯的产率是
 看图回答下列问题(部分仪器已被虚线遮挡,且虚线部分仪器可以根据需要添加)
看图回答下列问题(部分仪器已被虚线遮挡,且虚线部分仪器可以根据需要添加)(1)如果在虚线部分增加收集装置,上图中装置可用于实验室制取氨气,请回答以下问题:
①可以用
瓶口向下排空气集气法
瓶口向下排空气集气法
方法收集氨气,如果用烧瓶收集氨气,请用文字叙述如何检验氨气己收集满用润湿的红色石蕊试纸靠近烧瓶口,试纸变蓝,说明气体已收集满
用润湿的红色石蕊试纸靠近烧瓶口,试纸变蓝,说明气体已收集满
;②利用①中收集的氨气可以完成喷泉实验,是因为氨气具有
极易溶于水
极易溶于水
的物理性质;③写出实验室制氨气的化学反应方程式
2NH4Cl+Ca(OH)2
2NH3↑+CaCI2+2H2O
| ||
2NH4Cl+Ca(OH)2
2NH3↑+CaCI2+2H2O
;
| ||
(2)上图装置还可以用于完成某些固体物质受热分解的实验.请回答:
①Na2CO3和NaHCO3这两种物质中有一种可以用上图装置进行受热分解的实验.该物质受热分解的化学反应方程式为:
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
;
| ||
②请提出一点有关实验过程中安全问题的建议:
试管口向下倾斜
试管口向下倾斜
;③如果将12.6g的该物质加热分解,加热一段时间后,测得剩余固体质量为9.5g,则已经分解的该物质的质量为
8.4g.
8.4g.
g.