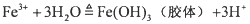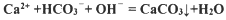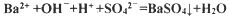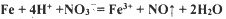摘要: 氢氧化铁胶体制备的方程式
网址:http://m.1010jiajiao.com/timu3_id_354344[举报]
(10分)
(1)制备氢氧化铁胶体的化学方程式为 。
(2)碳酸氢钠在水溶液中的电离方程式为 。
(3)能证明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡的事实是 (填选项字母)。
HSO3-+OH-水解平衡的事实是 (填选项字母)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色退去
B.滴入酚酞溶液变红,再加入氯水后红色退去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
(4)现有可逆反应:2A(g)+2B(g) C(g)+3D(s),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2 mol,Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。以下说法中正确的是 (填选项字母)。
C(g)+3D(s),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2 mol,Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。以下说法中正确的是 (填选项字母)。
A.Ⅰ、Ⅱ两条途径最终达到平衡时,体系内混合气体的百分组成相同
B.达到平衡时,途径Ⅱ所得混合气密度为途径Ⅰ所得混合气密度的2倍
C.达到平衡时,途径ⅡC的平衡浓度大于途径ⅠC的平衡浓度的2倍
(5)在恒容绝热(不与外界交换能量)条件下进行2A (g)+ B(g) 2C(g)+ D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系: 。
2C(g)+ D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系: 。
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
(1)制备氢氧化铁胶体的方法是:往烧杯中沸腾的蒸馏水内逐滴滴入饱和的FeCl3溶液,当烧杯中液体成为红棕色时停止加热,这个变化可以用化学方程式表示为:FeCl3+3H2O(沸水)==Fe(OH)3(胶体)+3HCl。证明得到的液体是氢氧化铁胶体的方法是______________。过滤所得到的氢氧化铁胶体,并用一束强光照射所得滤液,从垂直于光线的传播方向观察。该实验的目的是_______________。
(2)向盛有氢氧化钠溶液的烧杯中滴入饱和的FeCl3溶液,观察到有大量棕褐色的沉淀生成,得到的分散系属于__________(“溶液”、“浊液”、“胶体”)。这个变化可以用化学方程式表示为:___________。将得到的分散系过滤,滤纸上有大量的固体物质,滤液呈浅黄棕色,用一束强光照射,能观察到明显的丁达尔现象。通过这个实验你能得出的结论是:______________。
(3)氢氧化铁胶体与氢氧化铁悬浊液最本质的区别是:____________。
查看习题详情和答案>>
(2)向盛有氢氧化钠溶液的烧杯中滴入饱和的FeCl3溶液,观察到有大量棕褐色的沉淀生成,得到的分散系属于__________(“溶液”、“浊液”、“胶体”)。这个变化可以用化学方程式表示为:___________。将得到的分散系过滤,滤纸上有大量的固体物质,滤液呈浅黄棕色,用一束强光照射,能观察到明显的丁达尔现象。通过这个实验你能得出的结论是:______________。
(3)氢氧化铁胶体与氢氧化铁悬浊液最本质的区别是:____________。