网址:http://m.1010jiajiao.com/timu3_id_354327[举报]
海水是人类资源的宝库, “海水晒盐”是获取食盐的重要来源。食盐既是一种生活必需品,也是一种重要的工业原料。以食盐为原料可以得到多种产品。
⑴工业上用NaCl制备金属钠的化学方程式是 。
⑵工业上主要通过电解饱和氯化钠溶液的方法获得氢氧化钠。
①该过程中阴极的产物是 ;阴极反应为:
②阳极反应式为 ,检验该电极反应产物的方法是:
。
③当阴极上收集到标准状况下气体22.4L时(假设产生的气体完全被收集),则电路中通过电子的数目为 NA。
⑶电解氯化钠稀溶液可以制备“84”消毒液,若通电时产生的氯气被溶液完全吸收,且最终所得消毒液仅含一种溶质,请写出相应的化学方程式:
(用一个方程式表示)。
⑷海水电解制得的氢气用于合成氨,某合成氨厂生产流程如下:
①在第(1)个设备中先把N2 、H2压缩的目的是:
。
②在第(3)个设备中用冷却的方法分离出 其目的是:
。
查看习题详情和答案>>
氨是一种重要的基础化工原料,可以生产硝酸等一系列化工产品。德国人哈伯在1905年发明的合成氨反应原理为:
![]()
![]() ;
;![]()
回答下列问题:
(1)将10mol ![]() 和30mol
和30mol ![]() 装入密闭容器中,在一定条件下反应达到平衡,若有15%的
装入密闭容器中,在一定条件下反应达到平衡,若有15%的![]() 转化,则反应放出的热量是_______________kJ。
转化,则反应放出的热量是_______________kJ。
(2)工业合成氨生产中采取的措施是____________(填序号)
A. 采用较低压强
B. 采用700K左右的高温
C. 用铁触媒作催化剂
D. 将氨液化及时从混合物中分离,![]() 循环到合成塔中,并补充
循环到合成塔中,并补充![]()
(3)用下图所示装置(夹持固定装置已略去)在实验室中模拟工业制![]()

回答下列问题:
①实验时,A装置中盛放的试剂是__________________________;
装置B中反应的化学方程式为_______________________________________;
②C装置中盛放的试剂是_______________________________________;
该物质的主要作用是_______________________________________;
D装置的作用是_______________________________________;
③若将上图所示装置中虚线部分换成下图所示装置进行实验。反应开始前,分液漏斗中盛放的药品是______________________;烧瓶中盛放的药品是_____________________。

合成氨的发明是本世纪科学领域中最辉煌的成就之一。以下是与NH3相关的工业过程示意图。

已知:CH4(g) + 2O2(g) ==CO2(g)+2H2O(g)
△H = — 890kJ/mol
2CO(g) + O2(g) == 2CO2(g)
△H = — 566.0 kJ/mol
2H2(g) + O2(g) ==2H2O(g)
△H = — 571.6 kJ/mol
(1)请写出CH4(g)与O2(g)反应生成CO(g) 和H2(g)的热化学反应方程式:
_ 。
(2)生产中涉及H2和CO2的分离。你认为可取
的方法是(填代号) 。
A.在加压条件下用水吸收CO2
B.用NaOH溶液吸收CO2
C.加压,使CO2液化
(3)直接供氨式燃料电池在碱性条件下的负极反应为: 。
(4)合成尿素的反应分两步进行:
①CO2(g)+ 2NH3(g)![]() H2NCOONH4(aq)△H = — 159.47kJ/mol
H2NCOONH4(aq)△H = — 159.47kJ/mol
(氨基甲酸铵)
②H2NCOONH4(aq)![]() CO(NH2)2(aq)+ H2O(l)△H = + 28.49kJ/mol
CO(NH2)2(aq)+ H2O(l)△H = + 28.49kJ/mol
 在生产条件下,单位时间内获得尿素的产
在生产条件下,单位时间内获得尿素的产
量与压强和n(NH3):n(CO2)的关系如右图
所示。生产过程中n(NH3):n(CO2)的最佳
配比为 ,而实际生产往往使
n(NH3):n(CO2)≥3,这是因为
_ 。
在得到的尿素溶液中会含有少量的氨
基甲酸铵,除去这种杂质最简便的方法是 。
(5)将氨分为两部分,一部分经逐级氧化吸收转化为硝酸,另一部分又与HNO3反应生成NH4NO3。若HNO3与NH3的反应是完全的,有标准状况下78.4LNH3经上述反应过程生成120g NH4NO3。则NH3转化为HNO3的转化率为 _ 。
查看习题详情和答案>>
工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应如下图所示:
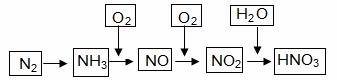 |
请回答:
(1)NO2与H2O反应中的还原剂是 。
(2)NH3与O2制取NO的化学反应方程式 。
(3)下列说法不正确的是(选填序号字母) 。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol NO2
(4)大量排放含N、P化合物的废水,会导致水体污染。其中含氮的物质主要是蛋白质,蛋白质在水中分解会产生氨气,氨气在微生物的作用下与氧气反应生成HNO2,上述氨气与氧气的反应中,氧化剂与还原剂的物质的量之比为 。
(5)已知:
H2(g) + ![]() O2(g) = H2O(g) △H1 = 241.8 kJ/mol
O2(g) = H2O(g) △H1 = 241.8 kJ/mol
![]() N2(g) + O2(g) = NO2 (g) △H2 = +33.9 kJ/mol
N2(g) + O2(g) = NO2 (g) △H2 = +33.9 kJ/mol
![]() N2(g) +
N2(g) + ![]() H2(g) = NH3 (g) △H3 = 46.0kJ/mol
H2(g) = NH3 (g) △H3 = 46.0kJ/mol
则17g氨气与氧气反应生成NO2(g)与H2O(g)时,△H= kJ/mol。
(6)氨气是氮肥工业的重要原料,某化肥厂生产铵态氮肥(NH4) 2SO4的工艺流程如下:
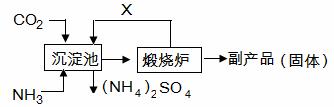 |
向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因是 。
查看习题详情和答案>>(13分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:
 混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: 
① 的△H 0(填“>”
的△H 0(填“>”
或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,
平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,
则K1 K2;反应进行到状 态D时,V正 v逆(填“>”、“<”或“=)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业
生产、生活中有着重要作用。
① 图是一定的温度和压强下是N2和H2反应生成1molNH3过
程中能量变化示意图,请写出工业合成氨的热化学反应方程式:
。(△H的数值用含字母Q1、Q2的代数式表示)
②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与
b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则
c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示该混合溶液中一水合出氨的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。已知:25 ℃时,KSP(AgCl)=1.6×10-10mol2·L-2、KSP(AgI)=1.5×10-16mol·L-2,在25℃下,向100mL 0.002mol·L-1的NaCl溶液中逐滴加入100mL 0.002mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
℃时,KSP(AgCl)=1.6×10-10mol2·L-2、KSP(AgI)=1.5×10-16mol·L-2,在25℃下,向100mL 0.002mol·L-1的NaCl溶液中逐滴加入100mL 0.002mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。