摘要:浓度对反应速率的影响为
网址:http://m.1010jiajiao.com/timu3_id_354316[举报]
化学反应速率的大小主要取决于反应物的性质,对此,人们所能做到的是改变影响反应速率的外界因素.有关下列实验所涉及的反应速率的描述或解释错误的是( )
查看习题详情和答案>>
| A.分别向盛有5mL0.1mol?L-1Na2CO3溶液、NaHCO3溶液的试管中加入3mL0.1mol?L-1盐酸,后者放出CO2气体快 |
| B.25℃时,一份双氧水样品经过2h,H2O2的浓度从5×10-2mol?L-1下降到3×10-2mol?L-1,该双氧水在这2h中分解的平均速率约是1.67×10-4mol?(L?min)-1 |
| C.用含硫矿石(如黄铁矿)燃烧制二氧化硫气体时,为了增大二氧化硫的生成速率,常将矿石粉碎成颗粒状、在沸腾炉内鼓入强大空气流,把矿石吹得剧烈翻腾 |
| D.H2能在O2中安静地燃烧,点燃H2和空气的混合气体可能会发生爆炸,前者是因为纯净的O2和H2反应较慢,后者是因为空气中含有大量的N2能促进H2的燃烧 |
化学反应速率的大小主要取决于反应物的性质,对此,人们所能做到的是改变影响反应速率的外界因素.有关下列实验所涉及的反应速率的描述或解释错误的是( )
A.分别向盛有5mL0.1mol?L-1Na2CO3溶液、NaHCO3溶液的试管中加入3mL0.1mol?L-1盐酸,后者放出CO2气体快
B.25℃时,一份双氧水样品经过2h,H2O2的浓度从5×10-2mol?L-1下降到3×10-2mol?L-1,该双氧水在这2h中分解的平均速率约是1.67×10-4mol?-1
C.用含硫矿石(如黄铁矿)燃烧制二氧化硫气体时,为了增大二氧化硫的生成速率,常将矿石粉碎成颗粒状、在沸腾炉内鼓入强大空气流,把矿石吹得剧烈翻腾
D.H2能在O2中安静地燃烧,点燃H2和空气的混合气体可能会发生爆炸,前者是因为纯净的O2和H2反应较慢,后者是因为空气中含有大量的N2能促进H2的燃烧
查看习题详情和答案>>
A.分别向盛有5mL0.1mol?L-1Na2CO3溶液、NaHCO3溶液的试管中加入3mL0.1mol?L-1盐酸,后者放出CO2气体快
B.25℃时,一份双氧水样品经过2h,H2O2的浓度从5×10-2mol?L-1下降到3×10-2mol?L-1,该双氧水在这2h中分解的平均速率约是1.67×10-4mol?-1
C.用含硫矿石(如黄铁矿)燃烧制二氧化硫气体时,为了增大二氧化硫的生成速率,常将矿石粉碎成颗粒状、在沸腾炉内鼓入强大空气流,把矿石吹得剧烈翻腾
D.H2能在O2中安静地燃烧,点燃H2和空气的混合气体可能会发生爆炸,前者是因为纯净的O2和H2反应较慢,后者是因为空气中含有大量的N2能促进H2的燃烧
查看习题详情和答案>>
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题.
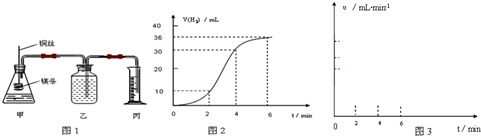
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中.足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示.
①请在图3 的方框中画出上述反应的速率与时间的关系曲线.并标出纵坐标的刻度值
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快.他决定对其原因进行探究.填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:
②该同学设计并进行了两组实验,即得出了正确结论.他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化.若观察到实验a中
查看习题详情和答案>>

(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中.足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示.
①请在图3 的方框中画出上述反应的速率与时间的关系曲线.并标出纵坐标的刻度值
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:
镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大;4min后由于溶液中H+浓度降低,所以导致反应速率减小
镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大;4min后由于溶液中H+浓度降低,所以导致反应速率减小
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快.他决定对其原因进行探究.填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:
Cl-对反应没有影响,而SO42-对反应具有阻碍作用
Cl-对反应没有影响,而SO42-对反应具有阻碍作用
;原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:
Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大)
Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大)
.②该同学设计并进行了两组实验,即得出了正确结论.他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化.若观察到实验a中
反应速率加快
反应速率加快
,实验b中反应速率减慢
反应速率减慢
,则说明原因Ⅲ是正确的.依此类推.该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用.影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题.
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中.足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示.写出该反应的离子方程式 ,在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因: .
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快.他决定对其原因进行探究.填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ: ;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ: .
②该同学设计并进行了两组实验,即得出了正确结论.他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化.
若观察到实验a中反应速率 ,实验b中反应速率 ,则说明原因Ⅲ是正确的.依此类推.该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用.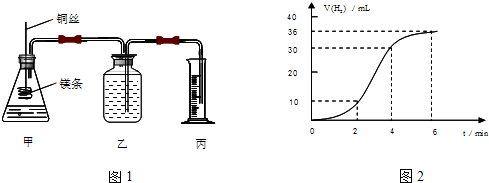
查看习题详情和答案>>
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中.足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示.写出该反应的离子方程式
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快.他决定对其原因进行探究.填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:
②该同学设计并进行了两组实验,即得出了正确结论.他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化.
若观察到实验a中反应速率
