摘要:8.四氧化三铁与盐酸
网址:http://m.1010jiajiao.com/timu3_id_354262[举报]
四氧化三铅(Pb3O4)俗名“红丹”,红丹中的PbO2在酸性条件下可以使Mn2+氧化为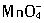 ,由于它具有氧化性,涂在钢材上有利于钢铁表面的钝化,故其防锈效果好,所以被大量地用于油漆船舶和桥梁钢架。
,由于它具有氧化性,涂在钢材上有利于钢铁表面的钝化,故其防锈效果好,所以被大量地用于油漆船舶和桥梁钢架。
今欲测定某样品中四氧化三铅的含量,称取该样品0.1000g,加入过量盐酸溶解后产生Cl2。将Cl2通入KI溶液中析出I2,用0.0l00mol?L-1Na2S2O3溶液滴定,反应如下:2Na2S2O3+I2=Na2S4O6+2NaI,达到终点时用去 Na2S2O3溶液25.00mL。
(1)请将红丹的化学式改写成如FeO?Fe2O3的形式:_____________________。
(2)写出Pb3O4 与盐酸反应的化学方程式:____________________________。
(3)用标准Na2S2O3溶液滴定I2时,可以选用的指示剂是_____________,达到终点时的现象是_______________________________________________________。
(4)计算试样中Pb3O4的质量分数。 查看习题详情和答案>>
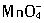 ,由于它具有氧化性,涂在钢材上有利于钢铁表面的钝化,故其防锈效果好,所以被大量地用于油漆船舶和桥梁钢架。
,由于它具有氧化性,涂在钢材上有利于钢铁表面的钝化,故其防锈效果好,所以被大量地用于油漆船舶和桥梁钢架。今欲测定某样品中四氧化三铅的含量,称取该样品0.1000g,加入过量盐酸溶解后产生Cl2。将Cl2通入KI溶液中析出I2,用0.0l00mol?L-1Na2S2O3溶液滴定,反应如下:2Na2S2O3+I2=Na2S4O6+2NaI,达到终点时用去 Na2S2O3溶液25.00mL。
(1)请将红丹的化学式改写成如FeO?Fe2O3的形式:_____________________。
(2)写出Pb3O4 与盐酸反应的化学方程式:____________________________。
(3)用标准Na2S2O3溶液滴定I2时,可以选用的指示剂是_____________,达到终点时的现象是_______________________________________________________。
(4)计算试样中Pb3O4的质量分数。 查看习题详情和答案>>
把铝粉和四氧化三铁粉末配成铝热剂,分成两等份。第一份在高温下恰好完全反应,然后将生成物与足量盐酸反应;第二份直接投入足量NaOH溶液中,充分反应。则前后两种情况下生成气体的体积之比为(相同状况下)
A.1∶1 B.9∶
有铝粉和四氧化三铁组成的铝热剂,在隔绝空气的条件下灼烧,使之充分反应。将所得混合物研细并分成两等份,分别投入过量的烧碱溶液和盐酸中,充分反应后,前者消耗m molNaOH,放出0.336 L 气体;后者消耗n mol HCl,放出V L气体。若将等质量的这种铝热剂中的铝粉与足量的稀硫酸反应,可得到3.36 L 气体(气体体积均在标准状况下测定)。求:
(1)该铝热剂的组成成分的质量分数。
(2)m、n、V的值。
查看习题详情和答案>>四种短周期元素A、B、C、D的性质或结构信息如下:
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题。
(1)B元素在周期表中的位置 ,请写出BC2分子的电子式 。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式。
①A元素的单质与物质甲发生的反应 。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应 。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中的现象是:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管底部出现红褐色沉淀。向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色。请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字。① ② ③ 。
查看习题详情和答案>>