摘要:13.下列说法正确的是 (A)配制0.1mol/L的NaCl溶液250mL.只需用以下仪器即可完成:托盘天平.烧杯.玻璃棒.250mL的容量瓶.胶头滴管 (B)快速配制室温时的NaCl饱和溶液不必使用温度计.溶解度表 (C)硅酸钠溶液可以保存在滴瓶中 (D)中和滴定时.眼睛必须注意:①滴定管中液面的变化.②锥形瓶内指示剂颜色的变化.③滴定管下端的液体流速
网址:http://m.1010jiajiao.com/timu3_id_354063[举报]
下列是模拟石油深加工来合成CH2=CHCOOCH2CH3(丙烯酸乙酯)等物质的过程:
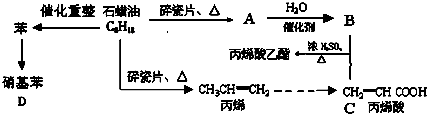
请回答下列问题:
(1)A的结构简式为:
(2)CH2=CHCOOCH2CH3的含氧官能团 (填名称)
(3)写出下列化学反应方程式
①B+C→CH2=CHCOOCH2CH3:
②丙烯→聚丙烯: ③苯→硝基苯如何加热?: .其优点是 .
(4)目前制备酒精的方法有两种:
方法一:A+HBr→CH3-CH2Br CH3-CH2Br+H2O
CH3CH2OH+HBr
方法二:(C6H10O5)n(淀粉)+nH2O
nM M
2C2H5OH+2CO2
①对方法一所涉及的有机反应类型分别为: ,
②对于方法二,M的分子式为:
③下列说法正确的是 (填代号)
A、从绿色化学的角度看方法一的原子利用率100%
B、从原料的可再生性来说,方法二最好
C、方法二产物乙醇储藏的化学能来自于太阳能. 查看习题详情和答案>>

请回答下列问题:
(1)A的结构简式为:
(2)CH2=CHCOOCH2CH3的含氧官能团
(3)写出下列化学反应方程式
①B+C→CH2=CHCOOCH2CH3:
②丙烯→聚丙烯:
(4)目前制备酒精的方法有两种:
方法一:A+HBr→CH3-CH2Br CH3-CH2Br+H2O
| NaOH |
| △ |
方法二:(C6H10O5)n(淀粉)+nH2O
| 淀粉酶 |
| 酒化酶 |
①对方法一所涉及的有机反应类型分别为:
②对于方法二,M的分子式为:
③下列说法正确的是
A、从绿色化学的角度看方法一的原子利用率100%
B、从原料的可再生性来说,方法二最好
C、方法二产物乙醇储藏的化学能来自于太阳能. 查看习题详情和答案>>
聚乳酸是一种新型可生物降解的高分子材料,以淀粉为原料合成聚乳酸的过程如下:
已知乳酸的结构简式为: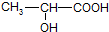
(1)写出下列反应的化学方程式.
反应①: ,
反应②: ,
反应③: .
(2)下列说法正确的是 (填字母).
A.淀粉是纯净物 B.可用碘水检验淀粉是否反应完全
C.乳酸能与新制Cu(OH)2反应 D.聚乳酸能发生水解反应. 查看习题详情和答案>>

已知乳酸的结构简式为:
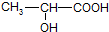
(1)写出下列反应的化学方程式.
反应①:
反应②:
反应③:
(2)下列说法正确的是
A.淀粉是纯净物 B.可用碘水检验淀粉是否反应完全
C.乳酸能与新制Cu(OH)2反应 D.聚乳酸能发生水解反应. 查看习题详情和答案>>
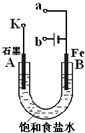 某课外活动小组用右图进行实验,试回答下列问题.
某课外活动小组用右图进行实验,试回答下列问题.(1)若开始时开关K与a连接,则B极的电极反应式为
(2)若开始时开关K与b连接,则B极的电极反应式为
(3)当开关K与b连接时,下列说法正确的是(填序号)
①溶液中Na+向B极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加入适量的盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移了0.2mol电子.
(1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ.则表示甲烷燃烧热的热化学方程式为
(2)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ?mol-1):
根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)=CF4(g)+4HF(g)△H=
(3)下列说法正确的是(填序号)
A.相同温度下,0.1mol?L-1NH4Cl溶液中NH4+的浓度比0.1mol?L-1氨水中NH4+的浓度大;
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气;
D.对于Al(OH)3(s)?Al(OH)3(aq)?Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;
E.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的大.
查看习题详情和答案>>
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ/mol
.(2)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ?mol-1):
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
CH4(g)+4F2(g)=CF4(g)+4HF(g)△H=
-1928kJ?mol-1
-1928kJ?mol-1
.(3)下列说法正确的是(填序号)
ABD
ABD
:A.相同温度下,0.1mol?L-1NH4Cl溶液中NH4+的浓度比0.1mol?L-1氨水中NH4+的浓度大;
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气;
D.对于Al(OH)3(s)?Al(OH)3(aq)?Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;
E.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的大.
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气.反应N2(g)+3H2(g)?2NH3(g)△H<0
①下列措施可以提高H2的转化率是(填选项序号) .
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应.若容器容积恒定,达到平衡状态时,容器内的压强是原来的
,则N2的转化率a1= ;
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2 a1(填“>”、“<”或“=”).
(2)以氨气、空气为主要原料制硝酸.
①NH3被氧气催化氧化生成NO的反应的化学方程式是 .
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)?2NO2(g)△H>0
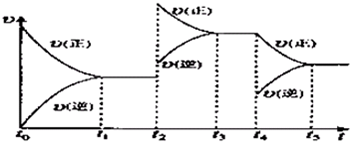
该反应的反应速率(v)随时间(t)变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) .
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
③向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2发生反应:
2NO2 (g)?N2O4(g)△H<0.恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1,a2.已知T1<T2,则a1 a2
A.大于 B.小于 C.等于 D.以上都有可能
(3)硝酸厂常用如下2种方法处理尾气.
①催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 .
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.
若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是 .
查看习题详情和答案>>

(1)以N2和H2为原料合成氨气.反应N2(g)+3H2(g)?2NH3(g)△H<0
①下列措施可以提高H2的转化率是(填选项序号)
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应.若容器容积恒定,达到平衡状态时,容器内的压强是原来的
| 15 | 16 |
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2
(2)以氨气、空气为主要原料制硝酸.
①NH3被氧气催化氧化生成NO的反应的化学方程式是
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)?2NO2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
③向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2发生反应:
2NO2 (g)?N2O4(g)△H<0.恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1,a2.已知T1<T2,则a1
A.大于 B.小于 C.等于 D.以上都有可能
(3)硝酸厂常用如下2种方法处理尾气.
①催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.
若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是