网址:http://m.1010jiajiao.com/timu3_id_353865[举报]
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1;
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
则N2(g)+3H2(g)?2NH3(g)△H=
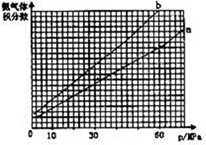
(2)合成氨反应中平衡混合物中氨气的体积分数与压强、温度的关系如图.若曲线a对应的温度为500℃,则曲线b对应的温度可能是
A.600℃B.550℃C.500℃D.450℃
(3)合成氨所需的氢气可由甲烷与水反应制备.发生反应为:CH4(g)+H2O(g)
| 催化剂 |
| 加热 |
在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
| t/min | CH4(mol?L-1) | H2O(mol?L-1) | CO(mol?L-1) | H2(mol?L-1) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.3 |
| 3 | n1 | n2 | n3 | 0.3 |
| 4 | 0.09 | 0.19 | x | 0.33 |
②反应在3~4min之间,氢气的物质的量增多的原因可能是
A.充入水蒸汽B.升高温度C.使用催化剂D.充入氢气
(4)已知:Kw(H2O)=1.0×10-14、Ksp[A1(OH)3]=1.3×10-33、Kb(NH3?H2O)=1.7×10-5,NH4++[A1(OH)4]-=A1(OH)3↓+NH3?H2O.向含有等物质的量NH4+、A13+、H+的混合溶液中慢慢加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应,其中:第二个离子反应的离子方程式是
氨气是一种重要工作原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)="2NO(g) " △ H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=_________________________。
(2)工业合成氨气的反应为N2(g)+3H2(g)  2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
①增大压强 ②增大反应物的浓度 ③使用催化荆 ④降低温度
( 3 )①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 ? 。实验室还可在 ? (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
②常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序
为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)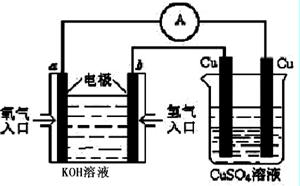
①氢氧燃料电池具有广阔的发展前景。如下图所示:
右边Cu电极反应式是 。
a电极的电极反应式
②工业上生产氢气是将水蒸气通过红热的炭,产生水煤气:
C(s) + H2O(g)  H2(g) + CO(g) △H =" +131.3" kJ/mol
H2(g) + CO(g) △H =" +131.3" kJ/mol
该反应在低温下不能自发进行的原因是 。
| A.△H >0 | B.温度较低时,△H影响为主 |
| C.△S<0 | D.温度较低时,△S影响为主 |
(1)已知:N2(g)+O2(g)="2NO(g) " △ H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=_________________________。
(2)工业合成氨气的反应为N2(g)+3H2(g)
 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。①增大压强 ②增大反应物的浓度 ③使用催化荆 ④降低温度
( 3 )①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 ? 。实验室还可在 ? (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
②常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序
为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)
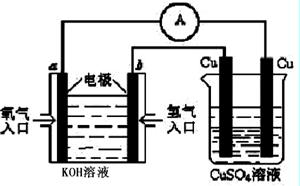
①氢氧燃料电池具有广阔的发展前景。如下图所示:
右边Cu电极反应式是 。
a电极的电极反应式
②工业上生产氢气是将水蒸气通过红热的炭,产生水煤气:
C(s) + H2O(g)
 H2(g) + CO(g) △H =" +131.3" kJ/mol
H2(g) + CO(g) △H =" +131.3" kJ/mol该反应在低温下不能自发进行的原因是 。
| A.△H >0 | B.温度较低时,△H影响为主 |
| C.△S<0 | D.温度较低时,△S影响为主 |
氨气是一种重要工作原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)=2NO(g) △ H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=_________________________。
(2)工业合成氨气的反应为N2(g)+3H2(g) ![]() 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是_________ _________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是_________ _________。
①增大压强 ②增大反应物的浓度 ③使用催化荆 ④降低温度
( 3 )①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 。实验室还可在 (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
② 常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③ 将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序
为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)

①氢氧燃料电池具有广阔的发展前景。如下图所示:
右边Cu电极反应式是 。
a电极的电极反应式
②工业上生产氢气是将水蒸气通过红热的炭,产生水煤气:
C(s) + H2O(g) ![]() H2(g) + CO(g) △H = +131.3 kJ/mol
H2(g) + CO(g) △H = +131.3 kJ/mol
该反应在低温下不能自发进行的原因是 。
A.△H >0 B.温度较低时,△H影响为主
C.△ S<0 D.温度较低时,△S影响为主
查看习题详情和答案>>氨气是一种重要工作原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)=2NO(g) △ H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=_________________________。
(2)工业合成氨气的反应为N2(g)+3H2(g) ![]() 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是_________ _________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是_________ _________。
①增大压强 ②增大反应物的浓度 ③使用催化荆 ④降低温度
( 3 )①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 ?? 。实验室还可在 ?? (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
② 常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③ 将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序
为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)

①氢氧燃料电池具有广阔的发展前景。如下图所示:
右边Cu电极反应式是 。
a电极的电极反应式
②工业上生产氢气是将水蒸气通过红热的炭,产生水煤气:
C(s) + H2O(g) ![]() H2(g) + CO(g) △H = +131.3 kJ/mol
H2(g) + CO(g) △H = +131.3 kJ/mol
该反应在低温下不能自发进行的原因是 。
A.△H >0 B.温度较低时,△H影响为主
C.△ S<0 D.温度较低时,△S影响为主
查看习题详情和答案>>