题目内容
氨是一种重要的化工产品.其合成原理为N2(g)+3H2(g)?2NH3(g)△H<0.
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1;
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1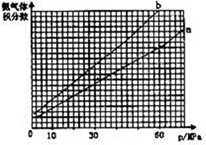
则N2(g)+3H2(g)?2NH3(g)△H= .
(2)合成氨反应中平衡混合物中氨气的体积分数与压强、温度的关系如图.若曲线a对应的温度为500℃,则曲线b对应的温度可能是 .
A.600℃B.550℃C.500℃D.450℃
(3)合成氨所需的氢气可由甲烷与水反应制备.发生反应为:CH4(g)+H2O(g)
CO(g)+3H2(g);△H>0
在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
①表中x= mol?L-1;前2min内CH4的平均反应速率为 .
②反应在3~4min之间,氢气的物质的量增多的原因可能是 (填代号)
A.充入水蒸汽B.升高温度C.使用催化剂D.充入氢气
(4)已知:Kw(H2O)=1.0×10-14、Ksp[A1(OH)3]=1.3×10-33、Kb(NH3?H2O)=1.7×10-5,NH4++[A1(OH)4]-=A1(OH)3↓+NH3?H2O.向含有等物质的量NH4+、A13+、H+的混合溶液中慢慢加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应,其中:第二个离子反应的离子方程式是 ,最后一个离子反应的离子方程式是 .
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1;
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1

则N2(g)+3H2(g)?2NH3(g)△H=
(2)合成氨反应中平衡混合物中氨气的体积分数与压强、温度的关系如图.若曲线a对应的温度为500℃,则曲线b对应的温度可能是
A.600℃B.550℃C.500℃D.450℃
(3)合成氨所需的氢气可由甲烷与水反应制备.发生反应为:CH4(g)+H2O(g)
| 催化剂 |
| 加热 |
在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
| t/min | CH4(mol?L-1) | H2O(mol?L-1) | CO(mol?L-1) | H2(mol?L-1) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.3 |
| 3 | n1 | n2 | n3 | 0.3 |
| 4 | 0.09 | 0.19 | x | 0.33 |
②反应在3~4min之间,氢气的物质的量增多的原因可能是
A.充入水蒸汽B.升高温度C.使用催化剂D.充入氢气
(4)已知:Kw(H2O)=1.0×10-14、Ksp[A1(OH)3]=1.3×10-33、Kb(NH3?H2O)=1.7×10-5,NH4++[A1(OH)4]-=A1(OH)3↓+NH3?H2O.向含有等物质的量NH4+、A13+、H+的混合溶液中慢慢加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应,其中:第二个离子反应的离子方程式是
分析:(1)根据盖斯定律构造目标热化学方程式,据此计算;
(2)合成氨是放热反应,压强一定,升高温度,平衡向逆反应方向移动,氨气的含量降低;
(3)由2min、3min氢气的浓度可知,2min达平衡状态,则:
CH4(g)+H2O(g)
CO(g)+3H2(g);
开始(mol/L):0.2 0.3 0 0
变化(mol/L):0.1 0.1 0.1 0.3
平衡(mol/L):0.1 0.2 0.1 0.3
4min时,甲烷、水蒸气、氢气的浓度变化分别为0.01、0.01、0.03,等于化学计量数之比,应是升高温度平衡向正反应方向移动,
根据氢气的浓度变化量,利用浓度变化量之比等于化学计量数之比计算CO的浓度;
根据v=
计算v(H2),再根据速率之比等于化学计量数之比计算v(CH4);
(4)令溶液中Al3+、H+的浓度都为1mol/L,则平衡时对应氢氧根离子的浓度分别为10-11、10-14,故H+先与氢氧根离子反应;水与一水合氨的电离结构类似,一水合氨的电离常数大,故NH4+结合OH-的能力比H+弱,由NH4++[Al(OH)4]-=Al(OH)3↓+NH3?H2O可知,NH4+结合OH-的能力比Al(OH)3,比Al3+弱,据此解答.
(2)合成氨是放热反应,压强一定,升高温度,平衡向逆反应方向移动,氨气的含量降低;
(3)由2min、3min氢气的浓度可知,2min达平衡状态,则:
CH4(g)+H2O(g)
| 催化剂 |
| 加热 |
开始(mol/L):0.2 0.3 0 0
变化(mol/L):0.1 0.1 0.1 0.3
平衡(mol/L):0.1 0.2 0.1 0.3
4min时,甲烷、水蒸气、氢气的浓度变化分别为0.01、0.01、0.03,等于化学计量数之比,应是升高温度平衡向正反应方向移动,
根据氢气的浓度变化量,利用浓度变化量之比等于化学计量数之比计算CO的浓度;
根据v=
| △c |
| △t |
(4)令溶液中Al3+、H+的浓度都为1mol/L,则平衡时对应氢氧根离子的浓度分别为10-11、10-14,故H+先与氢氧根离子反应;水与一水合氨的电离结构类似,一水合氨的电离常数大,故NH4+结合OH-的能力比H+弱,由NH4++[Al(OH)4]-=Al(OH)3↓+NH3?H2O可知,NH4+结合OH-的能力比Al(OH)3,比Al3+弱,据此解答.
解答:解:(1)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1;
②4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905kJ?mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
根据盖斯定律,③×
+①-②×
得N2(g)+3H2(g)?2NH3(g)故△H=
×(-483.6kJ?mol-1)+180.5kJ?mol-1-
×(-905kJ?mol-1)=-92.4kJ?mol-1,
故答案为:-92.4kJ?mol-1;
(2)合成氨是放热反应,压强一定,升高温度,平衡向逆反应方向移动,氨气的含量降低,由图象可知,曲线b表示氨气的含量高,故曲线b对应的温度应低于500℃,
故答案为:D;
(3)由2min、3min氢气的浓度可知,2min达平衡状态,则:
CH4(g)+H2O(g)
CO(g)+3H2(g);
开始(mol/L):0.2 0.3 0 0
变化(mol/L):0.1 0.1 0.1 0.3
平衡(mol/L):0.1 0.2 0.1 0.3
4min时,甲烷、水蒸气、氢气的浓度变化分别为0.01、0.01、0.03,等于化学计量数之比,应是升高温度平衡向正反应方向移动,
①4min时氢气的浓度变化量为0.33mol/L,故CO的浓度变化量x=0.33mol/L×
=0.11mol/L;
2min内v(H2)=
=0.15mol/(L?min),速率之比等于化学计量数之比,故v(CH4)=
v(H2)=
×0.15mol/(L?min)=0.05mol/(L?min),
故答案为:0.11;0.05mol/(L?min);
②由上述分析可知,4min时,甲烷、水蒸气、氢气的浓度变化分别为0.01、0.01、0.03,等于化学计量数之比,应是升高温度平衡向正反应方向移动,
故答案为:B;
(4)令溶液中Al3+、H+的浓度都为1mol/L,则平衡时对应氢氧根离子的浓度分别为10-11、10-14,故H+先与氢氧根离子反应;水与一水合氨的电离结构类似,一水合氨的电离常数大,故NH4+结合OH-的能力比H+弱,由NH4++[Al(OH)4]-=Al(OH)3↓+NH3?H2O可知,NH4+结合OH-的能力比Al(OH)3,比Al3+弱,即结合OH-的能力H+>Al3+>NH4+>Al(OH)3,故第二个离子反应的离子方程式是Al3++3OH-=Al(OH)3↓,最后一个离子反应的离子方程式是Al(OH)3+OH-=[Al(OH)4]-,
故答案为:Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=[Al(OH)4]-.
②4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905kJ?mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
根据盖斯定律,③×
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
故答案为:-92.4kJ?mol-1;
(2)合成氨是放热反应,压强一定,升高温度,平衡向逆反应方向移动,氨气的含量降低,由图象可知,曲线b表示氨气的含量高,故曲线b对应的温度应低于500℃,
故答案为:D;
(3)由2min、3min氢气的浓度可知,2min达平衡状态,则:
CH4(g)+H2O(g)
| 催化剂 |
| 加热 |
开始(mol/L):0.2 0.3 0 0
变化(mol/L):0.1 0.1 0.1 0.3
平衡(mol/L):0.1 0.2 0.1 0.3
4min时,甲烷、水蒸气、氢气的浓度变化分别为0.01、0.01、0.03,等于化学计量数之比,应是升高温度平衡向正反应方向移动,
①4min时氢气的浓度变化量为0.33mol/L,故CO的浓度变化量x=0.33mol/L×
| 1 |
| 3 |
2min内v(H2)=
| 0.3mol |
| 2min |
| 1 |
| 3 |
| 1 |
| 3 |
故答案为:0.11;0.05mol/(L?min);
②由上述分析可知,4min时,甲烷、水蒸气、氢气的浓度变化分别为0.01、0.01、0.03,等于化学计量数之比,应是升高温度平衡向正反应方向移动,
故答案为:B;
(4)令溶液中Al3+、H+的浓度都为1mol/L,则平衡时对应氢氧根离子的浓度分别为10-11、10-14,故H+先与氢氧根离子反应;水与一水合氨的电离结构类似,一水合氨的电离常数大,故NH4+结合OH-的能力比H+弱,由NH4++[Al(OH)4]-=Al(OH)3↓+NH3?H2O可知,NH4+结合OH-的能力比Al(OH)3,比Al3+弱,即结合OH-的能力H+>Al3+>NH4+>Al(OH)3,故第二个离子反应的离子方程式是Al3++3OH-=Al(OH)3↓,最后一个离子反应的离子方程式是Al(OH)3+OH-=[Al(OH)4]-,
故答案为:Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=[Al(OH)4]-.
点评:本题考查反应热计算、化学平衡的有关计算、平衡常数的应用等,题目综合性较大,难度较大,(4)中判断4min时改变条件是关键,(4)注意根据平衡常数、离子方程式判断结合氢氧根离子的能力强弱.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)传统哈伯法合成氨工艺中,N2+3H2 2NH3△H<0
2NH3△H<0
①该反应的平衡常数K的表达式为:K=______.升高温度,K值______(填“增大”、“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3 )
表中数据,______℃______MPa时H2的转化率最高,实际工业生产不选用该条件的主要原因是______.
③下列关于合成氨说法正确是______
A、使用催化剂可以提高NH3的产率
B、寻找常温下的合适催化剂是未来研究的方向
C、由于△H<0,△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.它既有液氢燃料电池的优点,又克服了液氢不易保存的不足.其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2═2N2+6H2O.写出负极电极反应式______,你认为电解质溶液应显______性(填“酸性”、“中性”、“碱性”),其原因是______.
(1)传统哈伯法合成氨工艺中,N2+3H2
 2NH3△H<0
2NH3△H<0①该反应的平衡常数K的表达式为:K=______.升高温度,K值______(填“增大”、“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3 )
| 压强(Mpa) 氨的平衡含(%) 温度(摄氏度) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
③下列关于合成氨说法正确是______
A、使用催化剂可以提高NH3的产率
B、寻找常温下的合适催化剂是未来研究的方向
C、由于△H<0,△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.它既有液氢燃料电池的优点,又克服了液氢不易保存的不足.其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2═2N2+6H2O.写出负极电极反应式______,你认为电解质溶液应显______性(填“酸性”、“中性”、“碱性”),其原因是______.