摘要:实验复习必须集中和分散相结合.提高重要实验的复现率 “集中 .就是集中复习实验的基本操作和技能.集中复习一些综合性的实验专题.集中归纳总结实验知识.而“分散 则是指一些性质实验.制法实验.验证或探索性实验等应分散到元素化合物.有机物.基本理论等的复习过程中去.通过实验.进一步理解元素化合物等知识.进一步理解相关的实验原理.提高运用实验手段解决化学问题的能力.节省复习时间.提高考试成绩.
网址:http://m.1010jiajiao.com/timu3_id_353585[举报]
可利用下图中的实验装置测定足量铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比(用m表示),其中装置C由广口瓶和量气管组成,量气管由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL~50mL),乙管可上下移动.回答下列问题:
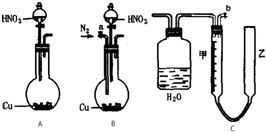
(1)实验中气体(NO和NO2)发生装置应选择
(2)实验中的气体(NO和NO2)通入C装置,请在下图的广口瓶中将导气管画出.
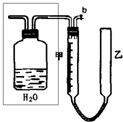
(3)要测定m值,需要将C中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验.因此,中和滴定前必须进行的操作是
(4)连接好装置,检查气密性后,应进行两步必要的操作:第一,打开b,向C装置的乙管中加适量水;第二,
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面.此时应进行的操作是
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L),C中硝酸的物质的量为 n mol,则用含n和V的式子表示m=
查看习题详情和答案>>

(1)实验中气体(NO和NO2)发生装置应选择
B
B
(填装置序号).(2)实验中的气体(NO和NO2)通入C装置,请在下图的广口瓶中将导气管画出.

(3)要测定m值,需要将C中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验.因此,中和滴定前必须进行的操作是
将C中的溶液加适量水稀释
将C中的溶液加适量水稀释
.(4)连接好装置,检查气密性后,应进行两步必要的操作:第一,打开b,向C装置的乙管中加适量水;第二,
打开a,通足量N2,排净装置中的空气
打开a,通足量N2,排净装置中的空气
.(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面.此时应进行的操作是
向下移动乙管,使甲、乙两管液面在同一水平面上
向下移动乙管,使甲、乙两管液面在同一水平面上
.(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L),C中硝酸的物质的量为 n mol,则用含n和V的式子表示m=
(V-11.2n):33.6n
(V-11.2n):33.6n
(结果可不必化简).现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度.(可供选用的反应物只有CaCO3固体、6mol/L盐酸、6mol/L硫酸和蒸馏水)回答下列问题:
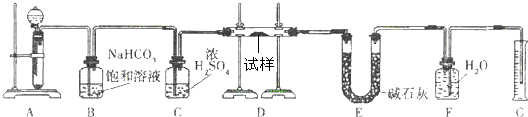
(1)实验前必须检查装置的气密性.仪器连接好后,在 中加适量的水,关闭A中分液漏斗阀门后微热试管,若看到 说明装置气密性好.
(2)装置A中液体试剂选用盐酸而不用硫酸,理由是 .
(3)装置B的作用是 ;装置C的作用是 ;装置E中碱石灰的作用是 .
(4)装置D中发生反应的化学方程式是: .
(5)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为 .
查看习题详情和答案>>

(1)实验前必须检查装置的气密性.仪器连接好后,在
(2)装置A中液体试剂选用盐酸而不用硫酸,理由是
(3)装置B的作用是
(4)装置D中发生反应的化学方程式是:
(5)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为
如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑、6mol/L硫酸溶液,其他试剂任选.填写下列空白:
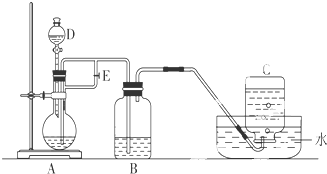
(1)D仪器的名称
(2)实验开始时应先将活塞E
(3)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:
查看习题详情和答案>>

(1)D仪器的名称
分液漏斗
分液漏斗
,该仪器中需要放入6mol/L硫酸
6mol/L硫酸
溶液,B中盛有一定量的NaOH溶液,A中应预先加入的试剂是Fe
Fe
,A中反应的离子方程式为Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
.(2)实验开始时应先将活塞E
打开
打开
(填“打开”或“关闭”),在C中收到的气体主要为氢气
氢气
;待装置中空气排尽后,将活塞E关闭
关闭
(填“打开”或“关闭”),此刻B瓶中可能发生的化学反应(用离子方程式表示)是H++OH-=H2O
H++OH-=H2O
、Fe2++2OH-=Fe(OH)2↓
Fe2++2OH-=Fe(OH)2↓
.(3)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.(2009?广州二模)乙酸乙酯是重要的化工原料,沸点约77℃.其水解反应方程式为CH3COOC2H5+H2O?CH3COOH+C2H5OH酸和碱均可用作该反应的催化剂.某兴趣小组对NaOH溶液催化乙酸乙酯水解进行了探究.
实验步骤:
向试管中加入8mLNaOH溶液,再加入2mL乙酸乙酯,用直尺量出乙酸乙酯的高度.再把试管放入70℃的水浴中,每隔1min将其取出,振荡,静置,立即测量并记录剩余酯层的高度.再迅速放回水浴中继续加热,如此反复进行.改变NaOH溶液浓度,重复实验.
数据记录:
乙酸乙酯水解后剩余的高度/min
回答下列问题:
(1)完成上述对比实验时,每组实验都必须控制不变的因素有
(2)分析上述数据,得到乙酸乙酯水解速率的结论是:
①NaOH溶液浓度越大,水解速率越
(3)结论②的理论解释是
(4)欲使乙酸乙酯完全水解,可采取的措施是
(5)有同学认为有必要用蒸馏水代替NaOH溶液重复试验,对数据进行修正,主要原因是
查看习题详情和答案>>
实验步骤:
向试管中加入8mLNaOH溶液,再加入2mL乙酸乙酯,用直尺量出乙酸乙酯的高度.再把试管放入70℃的水浴中,每隔1min将其取出,振荡,静置,立即测量并记录剩余酯层的高度.再迅速放回水浴中继续加热,如此反复进行.改变NaOH溶液浓度,重复实验.
数据记录:
乙酸乙酯水解后剩余的高度/min
| 组别 | C(NaOH)/mol?L-1 | 时间/min | ||||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 1 | 0.5 | 10.0 | 9.0 | 8.0 | 7.5 | 7.0 | 6.5 | 6.5 | 6.5 | 6.5 |
| 2 | 1.0 | 10.0 | 8.5 | 7.0 | 6.0 | 5.0 | 4.5 | 4.5 | 4.5 | 4.5 |
| 3 | 2.0 | 10.0 | 8.0 | 6.0 | 4.5 | 3.0 | 2.0 | 1.5 | 1.5 | 1.5 |
(1)完成上述对比实验时,每组实验都必须控制不变的因素有
NaOH溶液的体积乙酸乙酯的用量
NaOH溶液的体积乙酸乙酯的用量
、反应温度
反应温度
.(2)分析上述数据,得到乙酸乙酯水解速率的结论是:
①NaOH溶液浓度越大,水解速率越
快
快
②乙酸乙酯水解速率先快后慢,一段时间后停止水解
乙酸乙酯水解速率先快后慢,一段时间后停止水解
.(3)结论②的理论解释是
NaOH能与水解产物醋酸发生中和反应,随着反应的进行,NaOH浓度逐渐减小直到完全消耗,其催化作用也逐渐减弱直到没有催化作用
NaOH能与水解产物醋酸发生中和反应,随着反应的进行,NaOH浓度逐渐减小直到完全消耗,其催化作用也逐渐减弱直到没有催化作用
.(4)欲使乙酸乙酯完全水解,可采取的措施是
增大NaOH的浓度(或体积)
增大NaOH的浓度(或体积)
.(5)有同学认为有必要用蒸馏水代替NaOH溶液重复试验,对数据进行修正,主要原因是
乙酸乙酯水解过程中部分挥发
乙酸乙酯水解过程中部分挥发
.