题目内容
如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用铁屑、6mol/L硫酸溶液,其他试剂任选.填写下列空白:
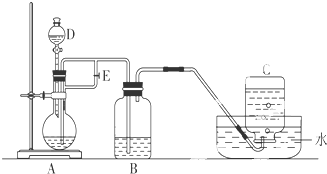
(1)D仪器的名称
(2)实验开始时应先将活塞E
(3)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:

(1)D仪器的名称
分液漏斗
分液漏斗
,该仪器中需要放入6mol/L硫酸
6mol/L硫酸
溶液,B中盛有一定量的NaOH溶液,A中应预先加入的试剂是Fe
Fe
,A中反应的离子方程式为Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
.(2)实验开始时应先将活塞E
打开
打开
(填“打开”或“关闭”),在C中收到的气体主要为氢气
氢气
;待装置中空气排尽后,将活塞E关闭
关闭
(填“打开”或“关闭”),此刻B瓶中可能发生的化学反应(用离子方程式表示)是H++OH-=H2O
H++OH-=H2O
、Fe2++2OH-=Fe(OH)2↓
Fe2++2OH-=Fe(OH)2↓
.(3)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.分析:(1)D的名称是分液漏斗,该仪器中需要放入液态反应物,A中应预先盛放固态反应物,铁和稀硫酸发生氧化还原反应生成硫酸亚铁;
(2)实验开始时,应先打开活塞,使生成的氢气进入整套实验装置中而排出空气,防止氢氧化亚铁被氧化;
关闭活塞时,A中溶液进入B装置中,A中溶液含有硫酸亚铁,可能含有硫酸,硫酸和硫酸亚铁都和氢氧化钠溶液反应;
(3)氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀.
(2)实验开始时,应先打开活塞,使生成的氢气进入整套实验装置中而排出空气,防止氢氧化亚铁被氧化;
关闭活塞时,A中溶液进入B装置中,A中溶液含有硫酸亚铁,可能含有硫酸,硫酸和硫酸亚铁都和氢氧化钠溶液反应;
(3)氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀.
解答:解:(1)D的名称是分液漏斗,该仪器中需要放入液态反应物6mol/L硫酸,A中应预先盛放固态反应物Fe,铁和稀硫酸反应生成硫酸亚铁和氢气,离子反应方程式为:Fe+2H+=Fe2++H2↑,
故答案为:分液漏斗;6mol/L硫酸;Fe;Fe+2H+=Fe2++H2↑;
(2)实验开始时,应先打开活塞,使生成的氢气进入整套实验装置中而排出空气,防止氢氧化亚铁被氧化,氢气不和水反应,所以C中收集的氢气主要是氢气,关闭活塞时,在气体压强的作用下,A中溶液进入B装置中,A中溶液含有硫酸亚铁,可能含有硫酸,硫酸和硫酸亚铁都和氢氧化钠溶液反应,所以发生的离子反应方程式可能为:H++OH-=H2O、Fe2++2OH-=Fe(OH)2↓,
故答案为:打开;H2;关闭;H++OH-=H2O;Fe2++2OH-=Fe(OH)2↓;
(3)氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀,所以看到的现象是:白色沉淀先转化为灰绿色最后转化为红褐色,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
故答案为:分液漏斗;6mol/L硫酸;Fe;Fe+2H+=Fe2++H2↑;
(2)实验开始时,应先打开活塞,使生成的氢气进入整套实验装置中而排出空气,防止氢氧化亚铁被氧化,氢气不和水反应,所以C中收集的氢气主要是氢气,关闭活塞时,在气体压强的作用下,A中溶液进入B装置中,A中溶液含有硫酸亚铁,可能含有硫酸,硫酸和硫酸亚铁都和氢氧化钠溶液反应,所以发生的离子反应方程式可能为:H++OH-=H2O、Fe2++2OH-=Fe(OH)2↓,
故答案为:打开;H2;关闭;H++OH-=H2O;Fe2++2OH-=Fe(OH)2↓;
(3)氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀,所以看到的现象是:白色沉淀先转化为灰绿色最后转化为红褐色,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评:本题考查了氢氧化亚铁的制取,难度不大,氢氧化亚铁极易被氧气氧气,所以制取氢氧化亚铁时注意必须在无氧气条件下进行反应,这是高中化学中较重要的一个实验,是学习重点.

练习册系列答案
相关题目
 实验室可用如图所示的装置制取气体,下列有关说法正确的是( )
实验室可用如图所示的装置制取气体,下列有关说法正确的是( )| A、实验室不能用这种装置来制取氢气 | B、这种装置可以不用加热试管来检查装置的气密性 | C、食盐跟浓硫酸反应制氯化氢的实验能用这种装置 | D、利用这种装置制取乙炔可以随制随停 |
 如图所示装置可用于多种实验.
如图所示装置可用于多种实验.
 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题: ,如图所示装置可用来制取
,如图所示装置可用来制取 并比较S元素与Br元素非金属性的强弱.
并比较S元素与Br元素非金属性的强弱.
 化合;
化合; 与Zn反应;而将浓
与Zn反应;而将浓