摘要:(1)3Na2S+As2S5=2Na3AsS4 (2)Na2S2+SnS=Na2SnS3 (3)Na2S+CS2=Na2CS3
网址:http://m.1010jiajiao.com/timu3_id_353338[举报]
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:

(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥,其主要目的是
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图一).其中a、c二步的化学方程式可表示为:
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图二所示.则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa.该反应的平衡常数等于
查看习题详情和答案>>

(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥,其主要目的是
防止催化剂中毒
防止催化剂中毒
.(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图一).其中a、c二步的化学方程式可表示为:
SO2+V2O5?SO3+V2O4
SO2+V2O5?SO3+V2O4
、4VOSO4+O2?2V2O5+4SO3
4VOSO4+O2?2V2O5+4SO3
.(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图二所示.则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa.该反应的平衡常数等于
400 L?mol-1
400 L?mol-1
.A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是使用常压SO2就可以达到较高的转化率
使用常压SO2就可以达到较高的转化率
. W是某短周期元素X的固态单质,A、B、C均为含X元素的酸式钠盐,它们在一定条件下有如图所示的转化关系,其中某些反应产物中的
W是某短周期元素X的固态单质,A、B、C均为含X元素的酸式钠盐,它们在一定条件下有如图所示的转化关系,其中某些反应产物中的H2O已略去.
(1)A的电子式可表示为


(2)A、B溶液与C溶液的反应与A、B溶液与G溶液的反应分别可以用相同离子反应方程式表示,写出以下反应的离子方程式:
A+C(A+G):
HS-+H+=H2S↑
HS-+H+=H2S↑
.(3)医学上常用含H的糖衣片给患贫血的病人补铁.对H来说,药片上的糖衣可以起到
防止氧化或隔绝空气
防止氧化或隔绝空气
作用.(4)由A、B与MgXO4组成的混合物,X元素的质量分数为a,则O元素的质量分数为
1-
a
| 7 |
| 4 |
1-
a
.| 7 |
| 4 |
填写下列空白:
(1)在戊烷的各种同分异构体中,氢谱只显示一个吸收峰的结构简式为
(2)烃A与含氢量最高的烃B属于同系物.在光照下1体积A最多能与6体积氯气完全反应(同温同压),则A的结构式是

(3)烷烃C的相对分子质量是72,C的一溴代物种数是它的同分异构体中最多的,A的名称是
(4)芳香烃D分子中含56个电子,碳与氢元素质量比为12:1,其聚合反应的化学方程式
 .
.
查看习题详情和答案>>
(1)在戊烷的各种同分异构体中,氢谱只显示一个吸收峰的结构简式为
C(CH3)4
C(CH3)4
(2)烃A与含氢量最高的烃B属于同系物.在光照下1体积A最多能与6体积氯气完全反应(同温同压),则A的结构式是


(3)烷烃C的相对分子质量是72,C的一溴代物种数是它的同分异构体中最多的,A的名称是
2-甲基丁烷(或异戊烷)
2-甲基丁烷(或异戊烷)
(4)芳香烃D分子中含56个电子,碳与氢元素质量比为12:1,其聚合反应的化学方程式


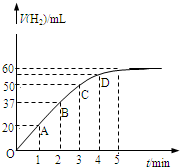 在恒温、恒容的密闭容器中发生如下反应:2HI(g)?H2(g)+I2(g),实验测定,在标准状况下产生氢气的体积和时间的关系如图所示.回答下列问题:
在恒温、恒容的密闭容器中发生如下反应:2HI(g)?H2(g)+I2(g),实验测定,在标准状况下产生氢气的体积和时间的关系如图所示.回答下列问题:(1)A、B、C、D四点对应的化学反应速率由快到慢顺序为
A>B>C>D
A>B>C>D
.(2)解释化学反应速率的大小变化原因
随反应的进行反应物HI的浓度逐渐减小
随反应的进行反应物HI的浓度逐渐减小
.(3)在5min后,收集到的氢气体积不再增加,原因是
该可逆反应达到平衡状态
该可逆反应达到平衡状态
.(4)下列叙述能说明上述反应达到最大限度的是
DE
DE
(填序号)A.HI、H2、I2的物质的量之比为2:1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗2mol HI,同时生成1mol H2
D.混合气体的颜色不随时间的变化而变化
E.HI、H2、I2的生成速率之比为2:1:1.