网址:http://m.1010jiajiao.com/timu3_id_352847[举报]
用砂纸擦后的镁带丐沸水反应,再向反应后溶液中滴加酚酞溶液向新制的H2S饱和溶液中滴加新制的氯水钠与润滴有酚酞的冷水反应镁带与2mol·L-1盐酸反应铝条与2mol·L-1盐酸反应向ALCI3溶液中滴加NaOH溶液至过量
A. 浮于水面,熔成闪亮的小球,四边游动,逐渐缩小,溶液变红色
B. 产生大量的气体,气体可燃,溶液变浅红色
C. 反应+分剧烈,产生的气体可燃
D. 剧烈反应,产生的气体可燃
E. 生成白色胶状沉淀,继而沉淀消失
F. 生成淡黄色沉淀
(3)实验内容:
实验方案 实验现象 有关化学方程
(4)实验结论:________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
现有下列短周期元素性质的数据:
元素编号
元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径
(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高和最
低化合价 +2 +1 +5 +7 +1 +5 +3
-2 -3 -1 -3
试回答下列问题:
(1)上述元素中处于同一主族的有________,元素②在周期表中的位置为________。
(2)上表中某两种元素,形成的分子中,每个原子都满足最外层为8电子的稳定结构,写出其电子式________。
(3)元素①⑥能形成两种化合物,写出其中较稳定的化,合物与水反应的,离子方程式:________。
查看习题详情和答案>>
A. 浮于水面,熔成闪亮的小球,四边游动,逐渐缩小,溶液变红色
B. 产生大量的气体,气体可燃,溶液变浅红色
C. 反应+分剧烈,产生的气体可燃
D. 剧烈反应,产生的气体可燃
E. 生成白色胶状沉淀,继而沉淀消失
F. 生成淡黄色沉淀
(3)实验内容:
实验方案 实验现象 有关化学方程
(4)实验结论:________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
现有下列短周期元素性质的数据:
元素编号
元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径
(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高和最
低化合价 +2 +1 +5 +7 +1 +5 +3
-2 -3 -1 -3
试回答下列问题:
(1)上述元素中处于同一主族的有________,元素②在周期表中的位置为________。
(2)上表中某两种元素,形成的分子中,每个原子都满足最外层为8电子的稳定结构,写出其电子式________。
(3)元素①⑥能形成两种化合物,写出其中较稳定的化,合物与水反应的,离子方程式:________。
查看习题详情和答案>>
已知亚硝酸铵很不稳定,在溶液中加热能分解生成氮气和水。有人设计以下装置(A中盛有饱和NaNO2、NH4Cl的混合溶液)来进行有关实验。如下图所示。

实验步骤如下:
①检查装置气密性。
②用酒精灯加热NH4Cl和NaNO2饱和溶液,待有气体生成,可停止加热,但仍有大量气体产生。
③再用酒精灯加热铁铈合金至一定温度。
④从胶头滴管中不断滴入一定浓度盐酸,不久发现石蕊试液变蓝。
请回答下列问题:
(1)本实验的主要目的是 。
(2)先加热NH4Cl和NaNO2饱和溶液的目的是 ,停止加热后,仍有大量气体生成的原因是 。
(3)B中应装_____________,其作用是 。
(4)C中铁铈合金的作用是 ,要先加热至一定温度的原因是 。
查看习题详情和答案>>

实验步骤如下:
①检查装置气密性。
②用酒精灯加热NH4Cl和NaNO2饱和溶液,待有气体生成,可停止加热,但仍有大量气体产生。
③再用酒精灯加热铁铈合金至一定温度。
④从胶头滴管中不断滴入一定浓度盐酸,不久发现石蕊试液变蓝。
请回答下列问题:
(1)本实验的主要目的是 。
(2)先加热NH4Cl和NaNO2饱和溶液的目的是 ,停止加热后,仍有大量气体生成的原因是 。
(3)B中应装_____________,其作用是 。
(4)C中铁铈合金的作用是 ,要先加热至一定温度的原因是 。
查看习题详情和答案>>
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
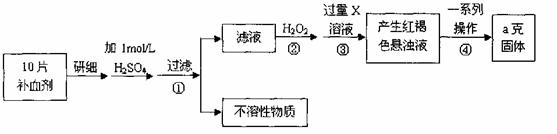
请回答下列问题:
(1))证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是 。
a.稀硝酸 b.稀硫酸 c.盐酸 d.浓硝酸
③滴定到终点时(恰好完全反应)的颜色为 色。k*s5u
查看习题详情和答案>>