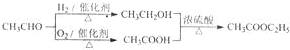摘要:(一)NaOH--苛性钠.火碱.烧碱 电解饱和食盐水 1.制法 熟石灰与纯碱反应--既是工业制法.也是实验室制少量NaOH方法. 2.物理性质--掌握极易溶于水.放出大量热(配制溶液时先溶解后冷却).由于强腐蚀性,称量NaOH固体不能在纸上称量.应在玻璃器皿中称量. 3.化学性质: CO2 酸性氧化物 NaOH保存 ①氧化物 SiO2 两性氧化物Al2O3 特殊氧化物 (制HNO3尾气吸收) ②酸碱指示剂 思考:如何证明Na2CO3溶液是否混有NaOH? (答:取样品加入酚酞试液.然后加过量BaCl2溶液.若红色不褪证明含NaOH.若红色褪去证明不含NaOH) ③某些金属(了解Be.Zn亦能与NaOH溶液反应) 思考:熔化NaOH固体.可选用的坩埚是 A.瓷坩埚 B.铁坩埚 C.Al2O3坩埚 D.石墨坩埚 ④某些非金属 ⑤与酸的反应 思考:a.醋酸与NaOH按1:2的物质的量比混合.蒸干灼烧.最后所得固体是什么? (答:Na2CO3.因为 ) b.硬脂酸()不溶于水.因而不能使指示剂变色.如何证明其具有酸性? (答:在热的NaOH溶液中加入酚酞.然后加入硬指酸.红色逐渐变浅.) ⑥与盐反应: a. 用于鉴定阳离子存在如: → (既用于鉴定NH4+.又用于实验室制NH3) 注意两者物质的量之比.如 b.与酸式盐反应 注意是何种盐.如只有当NaOH足量才能生成 一定生成Mg(OH)2沉淀等. OH ONa ⑦酚 +NaOH→ +H2O 思考:检验苯酚存在时.可利用如下反应: OH 6 +Fe3+ [Fe(C6H5O)6] 3-+6H+.在进行该实验时.适宜在PH值较大还是较 小的条件下进行?能否在强碱性条件下进行? 答:(PH值较大.不能.否则生成Fe(OH)3沉淀) NaOH水溶液发生水解反应 ⑧卤代烃 NaOH醇溶液发生消去反应 ⑨酯在NaOH存在下的水解反应
网址:http://m.1010jiajiao.com/timu3_id_352843[举报]
(2010?湘潭三模)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图甲装置进行有关实验,请回答:
(1)装置D中试管口放置的棉花中应浸一种液体,这种液体的作用是
(2)装置B的作用是贮存多余的气体,B中应放置的液体是(填字母)
a.NaOH溶液 b.酸性KmnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
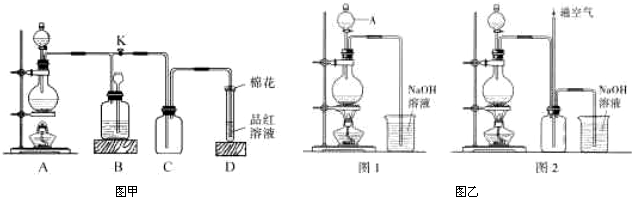
(3)铜不能与稀硫酸直接反应得到硫酸铜,但可用下面方法制取:将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发浓缩、冷却结晶可制得硫酸铜晶体(装置如图乙图1、2所示).
①将硝酸分多次加入到铜粉与稀硫酸的混合物中,写出该反应的离子方程式
②已知NO不能被NaOH溶液直接吸收,但已知有如下两个反应:
NO+NO2+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO3+NaNO2+H2O.图2是图1的改进装置,其优点除可以防止倒吸外还有:
(3)如果用1molCu来制取1molCuSO4,则所需12mol/L的硝酸体积为
查看习题详情和答案>>

(1)装置D中试管口放置的棉花中应浸一种液体,这种液体的作用是
防止SO2扩散而造成污染气体
防止SO2扩散而造成污染气体
.(2)装置B的作用是贮存多余的气体,B中应放置的液体是(填字母)
d
d
.a.NaOH溶液 b.酸性KmnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
长颈漏斗导管中液柱升高
长颈漏斗导管中液柱升高
.(3)铜不能与稀硫酸直接反应得到硫酸铜,但可用下面方法制取:将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发浓缩、冷却结晶可制得硫酸铜晶体(装置如图乙图1、2所示).
①将硝酸分多次加入到铜粉与稀硫酸的混合物中,写出该反应的离子方程式
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.②已知NO不能被NaOH溶液直接吸收,但已知有如下两个反应:
NO+NO2+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO3+NaNO2+H2O.图2是图1的改进装置,其优点除可以防止倒吸外还有:
促进氮的氧化物被充分吸收
促进氮的氧化物被充分吸收
.(3)如果用1molCu来制取1molCuSO4,则所需12mol/L的硝酸体积为
55.6
55.6
mL,(假设HNO3的还原产物全为NO),若所得尾气恰好被NaOH溶液完全吸收,需通入空气的体积为18.7L
18.7L
.(假设实验体积为标准状况下测定,并忽略装置中原有空气的影响,以上数据均保留小数点后一位.) I、下表是实验室制备气体的有关内容:
I、下表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | |
| ② | 制氨气 | NH4Cl→NH3 | |
| ③ | 制氯气 | HCl→Cl2 |
Cl2
Cl2
(填气体的化学式,下同);从反应中有无电子转移的角度看,明显不同于其他气体的是NH3
NH3
,写出实验室制取该气体的化学方程式Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
| ||
Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
.
| ||
(2)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其编号填入上表的空格中.
(3)若用上述制备O2的装置制备NH3,则选择的试剂为
浓氨水和氢氧化钠(或生石灰或碱石灰)
浓氨水和氢氧化钠(或生石灰或碱石灰)
.已知:NH3?H2O的电离方程式为:NH3?H2O?NH+4+OH-,试写出NH3溶于水后,形成的NH3?H2O的合理结构


(4)制备Cl2需用8mol?L-1的盐酸100mL,现用12mol?L-1的盐酸来配制.
①需要12mol?L-1的盐酸的体积为
66.7
66.7
mL(精确到0.1mL)②在容量瓶的使用方法中,下列操作不正确的是
BC
BC
(填写标号).A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住,用另一只手手指托住瓶底,把容量瓶倒转和摇动多次
II、(1)常温下,已知0.1mol?L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8.
写出该酸HA与NaOH溶液反应的离子方程式式:
HA+OH-═A-+H2O
HA+OH-═A-+H2O
;(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,
则该温度下(t℃),将100mL 0.1mol?L-1的稀H2SO4溶液与100mL 0.4mol?L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=
12
12
.自2009年3月起,从墨西哥、美国等国逐渐扩散到全世界的甲型H1N1型流感爆发疫情,引起全球关注和积极应对.防控专家表示,含氯消毒剂和过氧化物等强氧化性消毒剂可预防甲型H1N1型流感.
(1)过碳酸钠 (化学式2Na2CO3?3H2O2) 俗称固体双氧水,白色结晶颗粒.过碳酸钠溶于水或受热时,分解生成碳酸钠和过氧化氢,是很好的固体氧释放剂.
①请你写出过氧化氢的电子式
 ,其中氧元素的化合价是
,其中氧元素的化合价是
②H2O2有时可作为矿业废物消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:
KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为
③某强酸性反应体系中,反应物和生成物共六种物质;O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式
④实验室制O2主要有4种方法,用化学方程式写出任意一种
(2)碳酸钠水溶液显碱性.用离子方程式解释其原因
(3)漂白剂亚氯酸钠 (NaClO2) 在常温黑暗处可保存一年.亚氯酸不稳定可分解,反应的离子方程式为:
HClO2→ClO2↑+H++Cl-+H2O(未配平).在该反应中,当有1molClO2生成时,转移的电子数是
(4)ClO2不稳定,可与NaOH溶液、H2O2反应,转化为较稳定的亚氯酸钠 (NaClO2).该反应的化学方程式为
查看习题详情和答案>>
(1)过碳酸钠 (化学式2Na2CO3?3H2O2) 俗称固体双氧水,白色结晶颗粒.过碳酸钠溶于水或受热时,分解生成碳酸钠和过氧化氢,是很好的固体氧释放剂.
①请你写出过氧化氢的电子式


-1
-1
.②H2O2有时可作为矿业废物消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:
KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为
KHCO3
KHCO3
,H2O2被称为“绿色氧化剂”的理由是在反应体系中布引入杂质(或对环境无污染)
在反应体系中布引入杂质(或对环境无污染)
.③某强酸性反应体系中,反应物和生成物共六种物质;O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式
2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O
2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O
.④实验室制O2主要有4种方法,用化学方程式写出任意一种
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(2)碳酸钠水溶液显碱性.用离子方程式解释其原因
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
;pH值相同的①碳酸钠溶液、②醋酸钠溶液、③氢氧化钠溶液,其浓度由大到小的顺序是:②>①>③
②>①>③
(填写序号).(3)漂白剂亚氯酸钠 (NaClO2) 在常温黑暗处可保存一年.亚氯酸不稳定可分解,反应的离子方程式为:
HClO2→ClO2↑+H++Cl-+H2O(未配平).在该反应中,当有1molClO2生成时,转移的电子数是
NA
NA
个.(4)ClO2不稳定,可与NaOH溶液、H2O2反应,转化为较稳定的亚氯酸钠 (NaClO2).该反应的化学方程式为
2ClO2+2NaOH+H2O2═2NaClO2+O2↑+2H2O
2ClO2+2NaOH+H2O2═2NaClO2+O2↑+2H2O
.(2013?江西二模)以食盐为原料进行生产并综合利用的某些过程如图所示.
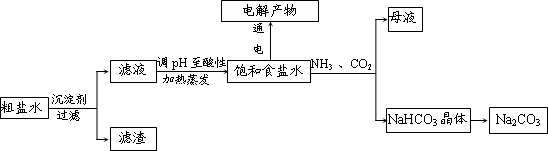
(1)除去粗盐中的Ca2+、Mg2+和SO4-2离子,加入下列沉淀剂的顺序是(填序号)
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是
(3)电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是
(5)某探究活动小组将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出).
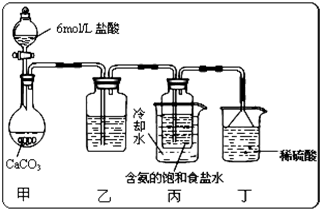
试回答下列有关问题:
①乙装置中的试剂是
②丁装置中稀硫酸的作用是
③实验结束后,分离出NaHCO3 晶体的操作是
(6)纯碱在生产生活中有广泛的应用.
①纯碱可用于除灶台油污.其原因是(结合离子方程式表述)
②工业上,可以用纯碱代替烧碱生产某些化工产品.如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是
查看习题详情和答案>>

(1)除去粗盐中的Ca2+、Mg2+和SO4-2离子,加入下列沉淀剂的顺序是(填序号)
cab或cba或bca
cab或cba或bca
.a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是
CO32-和OH-
CO32-和OH-
.(3)电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:
NaCl+H2O
NaClO+H2↑
| ||
NaCl+H2O
NaClO+H2↑
.
| ||
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是
NH3
NH3
.(5)某探究活动小组将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出).

试回答下列有关问题:
①乙装置中的试剂是
饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
;②丁装置中稀硫酸的作用是
吸收未反应的氨气
吸收未反应的氨气
;③实验结束后,分离出NaHCO3 晶体的操作是
过滤
过滤
(填分离操作的名称).(6)纯碱在生产生活中有广泛的应用.
①纯碱可用于除灶台油污.其原因是(结合离子方程式表述)
碳酸根离子水解显碱性,CO32-+H2O?HCO3-+OH-,油污在碱性条件下水解而被除去
碳酸根离子水解显碱性,CO32-+H2O?HCO3-+OH-,油污在碱性条件下水解而被除去
.②工业上,可以用纯碱代替烧碱生产某些化工产品.如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是
2CO32-+Cl2+H2O=2HCO3-+Cl-+ClO-
2CO32-+Cl2+H2O=2HCO3-+Cl-+ClO-
.(已知碳酸的酸性强于次氯酸).(2011?百色模拟)某有机物X的相对分子质量小于100,1mol有机物X完全燃烧生成等物质的量的CO2和H2O,同时消耗标准状况下的O2112L.
(1)该有机物X的分子式为
a.C4H8 b.C2H4O c.C4H8O2 d.C10H20O20
(2)甲物质是X的同分异构体,分子中含有羰基和羟基,物质甲能发生如图所示的转化:
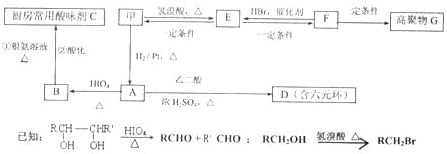
已知:
①B的名称是
②A→D的反应类型为
③写出F→G的化学方程式:
 .A-D的化学方程式
.A-D的化学方程式
 .
.
(3)物质乙也是X的同分异构体,1mol乙与足量的Na反应可生成1molH2,且乙不能使溴的CCl4溶液褪色,乙分子中的官能团连在相邻的碳原子上.乙中有三类氢原子,其个数比为2:1:1.PBS是一种新型生物降解塑料,其结构简式为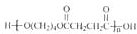
请设计合理方案以乙为原料(无机试剂自选)合成PBS(用合成路线流程图表示,并注明反应条件)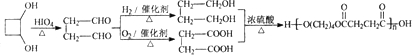
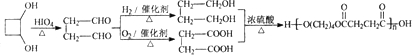 .
.
提示:I可利用本题(2)中的信息.II合成路线流程图示例如下:
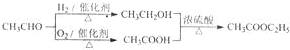
查看习题详情和答案>>
(1)该有机物X的分子式为
c
c
.a.C4H8 b.C2H4O c.C4H8O2 d.C10H20O20
(2)甲物质是X的同分异构体,分子中含有羰基和羟基,物质甲能发生如图所示的转化:

已知:
①B的名称是
乙醛
乙醛
.②A→D的反应类型为
取代反应
取代反应
,E→F的反应条件是NaOH/醇、加热
NaOH/醇、加热
.③写出F→G的化学方程式:




(3)物质乙也是X的同分异构体,1mol乙与足量的Na反应可生成1molH2,且乙不能使溴的CCl4溶液褪色,乙分子中的官能团连在相邻的碳原子上.乙中有三类氢原子,其个数比为2:1:1.PBS是一种新型生物降解塑料,其结构简式为
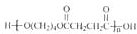
请设计合理方案以乙为原料(无机试剂自选)合成PBS(用合成路线流程图表示,并注明反应条件)
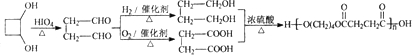
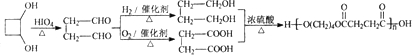
提示:I可利用本题(2)中的信息.II合成路线流程图示例如下: