网址:http://m.1010jiajiao.com/timu3_id_352838[举报]
化学反应变化过程及结果的研究。按要求回答问题:
(1)关于反应过程中能量变化的研究:
则:2CO(g)+O2(g)=2CO2(g)△H= kJ·mol-1。
(2)关于反应速率和限度的研究:
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变ΔH _______0 (填“>”、“<”或“=”)。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
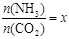 ,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
③上图中的B点处,NH3的平衡转化率为 。
(3)关于电化学的研究:
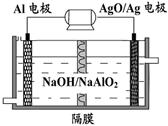
铝是日常生活中用途最多的金属元素,下图为Al-AgO电池的构造简图,电解质溶液为NaOH,它可用作水下动力电源,该电池中铝电极反应式为 。用该电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如下图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。

(4)关于电离平衡的研究:
人体血液里存在重要的酸碱平衡:
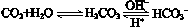 ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:| c(HCO3-)∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
试回答:
正常人体血液中,HCO3-的水解程度 电离程度(填“大于”、“小于”、“等于”);
②人体血液酸中毒时,可注射缓解 (填选项);
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③ pH=7.00的血液中,c(H2CO3) c(HCO3-) (填“<”、“>”、“=”) 查看习题详情和答案>>
(1)关于反应过程中能量变化的研究:

则:2CO(g)+O2(g)=2CO2(g)△H= kJ·mol-1。
(2)关于反应速率和限度的研究:
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3 (g)+ CO2 (g)
 CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变ΔH _______0 (填“>”、“<”或“=”)。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
 ,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
③上图中的B点处,NH3的平衡转化率为 。
(3)关于电化学的研究:
铝是日常生活中用途最多的金属元素,下图为Al-AgO电池的构造简图,电解质溶液为NaOH,它可用作水下动力电源,该电池中铝电极反应式为 。用该电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如下图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。


(4)关于电离平衡的研究:
人体血液里存在重要的酸碱平衡:
 ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:| c(HCO3-)∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
试回答:
正常人体血液中,HCO3-的水解程度 电离程度(填“大于”、“小于”、“等于”);
②人体血液酸中毒时,可注射缓解 (填选项);
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③ pH=7.00的血液中,c(H2CO3) c(HCO3-) (填“<”、“>”、“=”)
⑴(5分)随着生活水平的提高,人们越来越关注营养平衡和自身的健康。
①粮食中的淀粉在人体中水解最终转化成 ,该物质在人体内被氧化,最终生成CO2和H2O,该过程对人体健康的意义是 。
②有些元素是人的生命活动必不可少的,被称为必需元素,目前已经确认的必需元素共27种,其中有16种因为在人体中含量低于0.01%,称为微量元素,另11种元素则占据了人体体重的99.95%,如Na、Mg、K、Ca、P、S、Cl,请写出其余4种常量元素的元素符号________、________、_______、__________。
③构成蛋白质的常见氨基酸大约有20种,部分氨基酸可以在人体内合成,而有8种氨基酸人体自身不能合成,必须通过食物摄入,它们被称为“__________氨基酸”。
⑵(5分)中国是世界上最早研究和生产合金的国家之一。
①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点 。
②铜锌合金外观和金(Au)相似,常被误认为黄金。试写出一种鉴别黄铜与黄金的化学方法 。铜器表面容易生成一层薄薄的铜绿[主要成份是Cu2(OH)2CO3],请写出铜在潮湿的空气发生电化学腐蚀时的负极反应式 ;用盐酸可以除去铜器表面的铜绿,该反应的化学方程式为 。
③下列对金属制品采取的防护方法不正确的是 (填序号)。
A.在电线的外面包上一层塑料层
B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上锡块
⑶(5分)①CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。请你写出有利于降低大气中CO2浓度的一项措施 。
②水中含有重金属离子,可以用_____________去除(填“中和法”、“氧化还原法”、“沉淀法”),如含Cr3+离子的废水中可以加入___________(填化学式)。
③硝酸型酸雨的形成主要是有汽车排放的尾气所致。在汽车发动机中汽缸点火是,空气中的氧气和氮气反应生成NO,NO经过一系列变化形成硝酸,请写出这一过程中发生的反应方程式:___________________________,_____________________________________。
查看习题详情和答案>>(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源.
①硫-碘循环分解水制氢主要涉及下列反应:
I.SO2+2H2O+I2=H2SO4+2HIⅡ.2HI
| 通电 |
分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生l mol O2的同时产生1mol H2
②利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol?L-1;c(H2O)=8.5mol?L-1;c(CO)=2.0mol?L-1;c(H2)=2.0mol?L-1,则此时正逆反应速率的关系是v正
③实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)
| 加热 |
①下列各项中,不能说明该反应已达到平衡的是
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1mol CO,同时生成l mol CH3OH
②如图甲是该反应在不同温度下CO的转化率随时间变化的曲线.T1和T2温度下的平衡常数大小关系是K1
③已知甲醇燃料电池的工作原理如图乙所示.
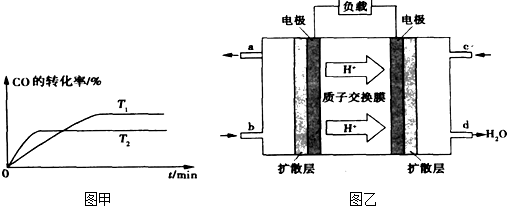
①该电池工作时,b口通入的物质为
A.生产普通玻璃的原料是石灰石、石英、纯碱,在玻璃熔炉中发生复杂的物理化学变化
B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的
C.加热法只适用于软化暂时硬度的硬水
D.工业上采用电解熔融氯化铝生产金属铝
E.用高纯度焦炭与石英砂反应可制得纯度达到9个9的单晶硅材料
(II)工业上制取硝酸铵的流程图如图甲,请回答下列问题:
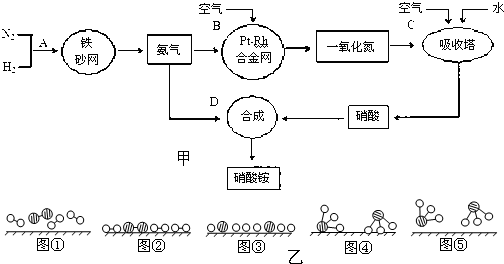
(1)1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如图乙:
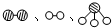 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______、______.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______、______.(2)在合成氨的设备(合成塔)中,设置热交换器的目的是______;在合成硝酸的吸收塔中通入空气的目的是______.
(3)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH═2NaNO2+H2O
NH3还原法:8NH3+6NO2
| ||
| △ |
请从绿色化学的角度分析两种方法的优劣:
(4)某化肥厂用NH3制备NH4NO3.已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的______%.
(5)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表.
| 注意事项 | 理由 | |
| ① | ||
| ② |