网址:http://m.1010jiajiao.com/timu3_id_352786[举报]

图4-19
(1)a电极材料应为_________;b电极材料为________。b电极的电极反应式为_______。
(2)电解液c可以是(填编号)__________________。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为_______________,在加入苯之前,对c溶液应作何简单处理?
(4)为了在较短时间内看到白色沉淀,可采取的措施有____________。
A.改用稀硫酸作电解液 B.适当增大电源的电压
C.适当减小两电极间的距离 D.适当降低电解液的浓度
查看习题详情和答案>>

(1)a电极材料应为 ,电极反应式为 。
(2)电解液c可以是(填编号) 。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为一苯层,其作用为 ,在加入苯之前对c应作何简单处理? 。
(4)若c中用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象是 。
查看习题详情和答案>> 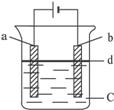
图6-28
(1)a电极材料应为____________,电极反应式为_________________。
(2)电解液C可以(填编号)是_____________。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是___________,在加入苯之前对C应作何简单处理________________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)___________。
A.改用稀硫酸作电解液 B.适当增大电源的电压
C.适当减小两电极间的距离 D.适当降低电解液的温度
(5)若C中用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一现象是_______________________________。
查看习题详情和答案>>
(1)a电极材料应为____________,b电极的电极反应式为______________。
(2)电解液c可以是____________(填编号)。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为________________________,在加入苯之前,对c溶液应做简单处理____________________________________________________________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是____________(填编号)。
A.改用稀硫酸作电解液 B.适当增大电源的电压
C.适当减小两电极间的距离 D.适当降低电解液的浓度
查看习题详情和答案>>