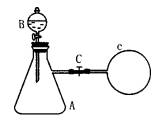
摘要: 如图所示.在支管锥形瓶A中充满等体积的H2S和NO气体,在分液漏斗B中盛有淀粉碘化钾溶液,在锥形瓶的支管处用弹簧夹b夹紧.并充满O2的气球C.根据实验.填写: (1).打开分液漏斗的活塞a.将漏斗中的溶液缓慢的流入A中. 发生的变化是:( H2S 气体溶于KI溶液中 ). 请判断:( ) (2).松开弹簧夹b.气球C逐渐 . 锥形瓶A中的气体 颜色立即变成 . ( ) (A)增大 棕色 (B)缩小 红色 (C)缩小 棕色 (D)增大 红色 (3).锥形瓶A中的溶液开始变混浊.这是因为 . . ( ) (A)2NO + O2 = 2NO2 (B) H2S + 2NO2 = 2HNO3 + S (C)2KI + 2NO2 = 2KNO3 + I2 (D)以上都不对. (4).锥形瓶A中的溶液开始变混浊.在溶液中变混浊的同时. 溶液出现浅蓝色.这是因为( ) (A)2NO + O2 = 2NO2 (B)H2S + 2NO2 = 2HNO3 + S (C)2KI + 2NO2 = 2KNO3 + I2 (D)以上都不对.2. 在实验室中制取少量乙酸乙酯的主要步骤如下: ① 把2毫升乙醇.1毫升浓硫酸装入反应的试管中.再加入2毫升10% 的醋酸. ② 在收集试管中.装入饱和的NaOH 溶液.组装好全部装置. ③ 将反应试管加强热.保持剧烈沸腾. ④ 倒出收集试管中的上层液体.即得到产品乙酸乙酯. 指出以上①-④步骤中的主要错误.并回答有关问题: 错误处: ① . ② . ③ . ④ . 问题: (1).步骤③操作的作用是(应小心加热.使酯化反应充分进行.并把乙酸乙酯蒸出). 判断对错:( ) (2).收集试管中的导管为什么不能插入溶液中? [答]: (3).乙酸乙酯的主要用途是 . . 3. 根据下列图示.回答问题. (1).原两种黑色粉末的名称是, 判断对错:( ) W 盐的化学式为( ALCL3 ). 判断对错:( ) (2). X 与Mg 的反应的化学方程式为: CO2 + 2Mg = 2MgO + C. 判断对错: (3). Z 溶液呈酸性的主要原因是NaHSO4 = Na + H + SO. 判断对错: ( )
网址:http://m.1010jiajiao.com/timu3_id_352580[举报]
如图所示,在支管锥形瓶A中充满等体积的H2S和NO气体;在分液漏斗B中盛有碘化钾溶液;在锥形瓶的支管处用橡胶管连接一个盛有O2的气囊C(与锥形瓶的体积约相等),用铁夹夹紧。当加入碘化钾溶液后,再打开铁夹并振荡锥形瓶,下列各化学方程式肯定不符合化学事实的是( )

A.2NO+O2══2NO2
B.2H2S+3O2══2SO2+2H2O
C.2KI+2NO2══2KNO2+I2
D.H2S+HNO3══HNO2+S↓+H2O
查看习题详情和答案>>