题目内容
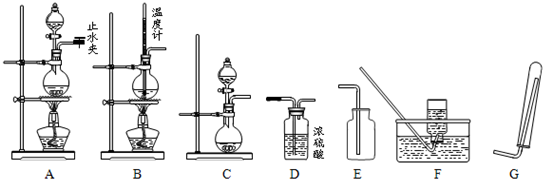
如图3-3所示,在支管锥形瓶A中充满等体积的H2S和NO气体;在分液漏斗B中盛有碘化钾溶液;在锥形瓶的支管处用橡胶管连接一个盛有O2的气囊C(与锥形瓶的体积约相等),用铁夹夹紧。当加入碘化钾溶液后,再打开铁夹并振荡锥形瓶,下列各化学方程式肯定不符合化学事实的是( ) 
图3-3
A.NO+O2====NO2 B.2H2S+3O2====2SO2+H2O
C.2KI+2NO2====2KNO2+I2 D.H2S+HNO3====HNO2+S↓+H2O
解析:NO遇O2发生反应生成NO2是大家很容易推断的,若考虑到NO2的氧化性,其他反应也可相应推断出。NO2能使湿润的KI淀粉试纸变蓝,可知反应2KI+2NO2====2KNO2+I2也有可能发生;NO2溶于水生成的HNO3也具有氧化性,能氧化H2S,故反应H2S+HNO3====HNO2+S↓+H2O也可能发生。H2S和O2只有在加热或者点燃的条件下才能反应,B选项不可能发生。
答案:B

(14分)为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
|
编号 |
操作 |
实验现象 |
|
① |
分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 |
试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
|
② |
另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 |
试管A、B中均未明显见到有 气泡产生。 |
(1)过氧化氢分解的化学方程式为__________________________________________。
(2)实验①的目的是______________________________________________________。实验中滴加FeCl3溶液的目的是_________________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是_________________________________(用实验中所提供的几种试剂)。
(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
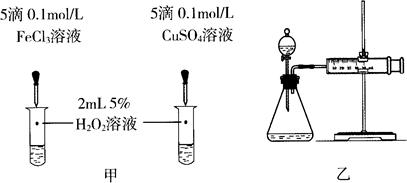
①定性分析:如图甲可通过观察_________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_________________________。
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_________________________。
 (1)下列关于实验操作的叙述中正确的为
(1)下列关于实验操作的叙述中正确的为