摘要:17.在一容积可调的密闭容器内使乙烯和活性炭接触.一部分乙烯被活性炭吸附.使压强减小.吸附总伴随着热的放出.在一定温度下.单位质量的活性炭中所吸附的乙烯的质量随压强的改变所应有的关系正确的是(图中T1.T2表示温度.且T1>T2) ( )
网址:http://m.1010jiajiao.com/timu3_id_352511[举报]
| (2013?丰台区二模)在一容积为2L的恒容密闭容器中加入0.2mol CO和0.4mol H2,发生如下反应:( ) CO(g)+2H2(g)?CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
|
查看习题详情和答案>>
在一容积为2L的恒容密闭容器中加入0.2mol CO和0.4mol H2,发生如下反应:( )
CO(g)+2H2(g)?CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
A.该反应的焓变△H>0,升高温度K增大
B.300℃时,0~20 min H2的平均反应速率 ν(H2)=0.003mol/
C.采取加压、增大H2浓度、加入催化剂的措施都能提高CO的转化率
D.500℃下,向该容器中初始加入0.1 mol CO和0.3 mol H2,依据现有数据可计算出反应达平衡后甲醇的浓度
查看习题详情和答案>>
CO(g)+2H2(g)?CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
甲醇物 时间 质的量 温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
| 500℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
A.该反应的焓变△H>0,升高温度K增大
B.300℃时,0~20 min H2的平均反应速率 ν(H2)=0.003mol/
C.采取加压、增大H2浓度、加入催化剂的措施都能提高CO的转化率
D.500℃下,向该容器中初始加入0.1 mol CO和0.3 mol H2,依据现有数据可计算出反应达平衡后甲醇的浓度
查看习题详情和答案>>
在自然界中,碳及其化合物之间进行着永不停息的转化,这些转化是非常重要的。
(1)在空气中久置的石灰水往往会失效,不能再用来检验二氧化碳气体。石灰水在空气中失效的原因可以用化学方程式表示为___________;石灰水失效后的试剂瓶内壁附着有白色物质,要清除这些物质可用的试剂是____________________。
(2)曰前大多数机动车都是采用化石燃料(燃油或燃气),使用化石燃料的机动车尾气中含有CO、NO等污染物。汽车排气管道中安装催化转化器,可使CO、NO等有害气体转化为无毒物质,从而减少尾气中有害物质的排放。已知反应:
①N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
②2C(s)+O2(g)=2CO(g) △H=-221.0kJ/mol
③C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
则反应④2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=__________kJ/mol。一定条件下,在一容积为1L的密闭恒容容器中通入2molNO和2molCO,在一定条件下发生上述反应④,下列不能说明反应达到平衡状态的是____________。
N2(g)+2CO2(g)的△H=__________kJ/mol。一定条件下,在一容积为1L的密闭恒容容器中通入2molNO和2molCO,在一定条件下发生上述反应④,下列不能说明反应达到平衡状态的是____________。
a.NO和CO的体积比保持不变
b.混合气体的平均摩尔质量保持不变
c.体系内压强保持不变
d.每生成1molN2的同时消耗2molCO2
测得上述反应达到平衡时,CO2的物质的量是CO的2倍,则该温度下的化学平衡常数K=________。
(3)大气中过多的二氧化碳会导致地球温室效应,给地球带来灾难,二氧化碳可以溶解在碱液中。现将1.12L(标准状况)CO2通入体积为100mL浓度为1mol/L的NaOH溶液中,该反应的离子方程式为_________________,所得溶液中离子浓度由大到小的顺序为________________________________。
查看习题详情和答案>>
(1)在空气中久置的石灰水往往会失效,不能再用来检验二氧化碳气体。石灰水在空气中失效的原因可以用化学方程式表示为___________;石灰水失效后的试剂瓶内壁附着有白色物质,要清除这些物质可用的试剂是____________________。
(2)曰前大多数机动车都是采用化石燃料(燃油或燃气),使用化石燃料的机动车尾气中含有CO、NO等污染物。汽车排气管道中安装催化转化器,可使CO、NO等有害气体转化为无毒物质,从而减少尾气中有害物质的排放。已知反应:
①N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
②2C(s)+O2(g)=2CO(g) △H=-221.0kJ/mol
③C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
则反应④2NO(g)+2CO(g)
 N2(g)+2CO2(g)的△H=__________kJ/mol。一定条件下,在一容积为1L的密闭恒容容器中通入2molNO和2molCO,在一定条件下发生上述反应④,下列不能说明反应达到平衡状态的是____________。
N2(g)+2CO2(g)的△H=__________kJ/mol。一定条件下,在一容积为1L的密闭恒容容器中通入2molNO和2molCO,在一定条件下发生上述反应④,下列不能说明反应达到平衡状态的是____________。 a.NO和CO的体积比保持不变
b.混合气体的平均摩尔质量保持不变
c.体系内压强保持不变
d.每生成1molN2的同时消耗2molCO2
测得上述反应达到平衡时,CO2的物质的量是CO的2倍,则该温度下的化学平衡常数K=________。
(3)大气中过多的二氧化碳会导致地球温室效应,给地球带来灾难,二氧化碳可以溶解在碱液中。现将1.12L(标准状况)CO2通入体积为100mL浓度为1mol/L的NaOH溶液中,该反应的离子方程式为_________________,所得溶液中离子浓度由大到小的顺序为________________________________。
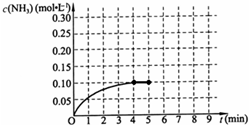 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0;反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0;反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)为
0.025mol/(L?min)
0.025mol/(L?min)
.(2)该反应到平衡时H2的转化率是
50%
50%
.(3)若容器容积不变,下列措施可增加NH3产率的是
BD
BD
.A.升高温度 B.将NH3(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.2molN2和0.6molH2
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡向
向正反应方向
向正反应方向
移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数不变
不变
(填“增大”、“减少”或“不变”). 氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:
氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)+Q(Q>0)
完成下列填空:
(1)某温度下该反应在一容积为2L的密闭容器中进行,2min后达到平衡,刚好有2mol电子发生转移,则2min内反应的速率为:v(CO)=
0.25mol/L?min
0.25mol/L?min
;该反应的平衡常数表达式为| c6(CO) |
| c2(N2) |
| c6(CO) |
| c2(N2) |
(2)其它条件不变时仅增大压强,则
c
c
.a.K值减小,平衡向逆反应方向移动
b.K值增大,平衡向正反应方向移动
c.K值不变,平衡向逆反应方向移动
d.K值不变,平衡向正反应方向移动
(3)一定条件下能说明上述反应已达平衡的是
cd
cd
.a.c(N2 ):c(CO)=1:3 b.3v(N2 )=v(CO) c.固体质量不再改变 d.气体密度不再改变
(4)达到平衡后改变某一条件,反应速率v与时间t的关系如图所示.
若不改变N2与CO的量,则图中t4时引起变化的原因可能是
升高温度后压缩体积增大压强
升高温度后压缩体积增大压强
;图中t6时引起变化的原因可能是加入催化剂
加入催化剂
.由图可知,平衡混合物中CO含量最高的时间段是t3~t4
t3~t4
.