题目内容
 氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:
氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)+Q(Q>0)
完成下列填空:
(1)某温度下该反应在一容积为2L的密闭容器中进行,2min后达到平衡,刚好有2mol电子发生转移,则2min内反应的速率为:v(CO)=
0.25mol/L?min
0.25mol/L?min
;该反应的平衡常数表达式为| c6(CO) |
| c2(N2) |
| c6(CO) |
| c2(N2) |
(2)其它条件不变时仅增大压强,则
c
c
.a.K值减小,平衡向逆反应方向移动
b.K值增大,平衡向正反应方向移动
c.K值不变,平衡向逆反应方向移动
d.K值不变,平衡向正反应方向移动
(3)一定条件下能说明上述反应已达平衡的是
cd
cd
.a.c(N2 ):c(CO)=1:3 b.3v(N2 )=v(CO) c.固体质量不再改变 d.气体密度不再改变
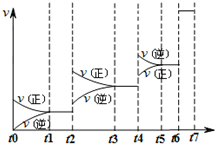
(4)达到平衡后改变某一条件,反应速率v与时间t的关系如图所示.
若不改变N2与CO的量,则图中t4时引起变化的原因可能是
升高温度后压缩体积增大压强
升高温度后压缩体积增大压强
;图中t6时引起变化的原因可能是加入催化剂
加入催化剂
.由图可知,平衡混合物中CO含量最高的时间段是t3~t4
t3~t4
.分析:(1)根据转移电子和一氧化碳的关系式计算一氧化碳的物质的量,再根据v(CO)=
计算;
平衡常数K=
;
(2)其它条件不变时仅增大压强,平衡向气体体积减小的方向移动,平衡常数只与温度有关;
(3)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,可以及由此衍生的一些量也不发生变化,由此进行判断;
(4)若不改变N2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为升高温度后压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂;
t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高.
| ||
| △t |
平衡常数K=
| c6(CO) |
| c2(N2) |
(2)其它条件不变时仅增大压强,平衡向气体体积减小的方向移动,平衡常数只与温度有关;
(3)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,可以及由此衍生的一些量也不发生变化,由此进行判断;
(4)若不改变N2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为升高温度后压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂;
t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高.
解答:解:(1)3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)+Q(Q>0)中,当有2mol电子转移时,生成n(CO)=
×1=1mol,v(CO)=
=
=0.25 mol/L?min,平衡常数K=
,
故答案为:0.25 mol/L?min,平衡常数K=
;
(2)其它条件不变时仅增大压强,平衡向气体体积减小的方向移动,平衡常数只与温度有关,所以该反应向逆反应方向移动,温度不变平衡常数不变,故选c;
(3)a.当c(N2 ):c(CO)=1:3时,该反应不一定达到平衡状态,这与反应物浓度和转化率有关,故错误;
b.无论该反应是否达到平衡状态,都存在3v(N2 )=v(CO),故错误;
c.当固体质量不再改变时,该反应达到平衡状态,故正确;
d.当气体密度不再改变时,各物质的浓度不再改变,该反应达到平衡状态,故正确;
故选c、d;
(4)若不改变N2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为升高温度后压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂;
t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;
故答案为:升高温度后压缩体积增大压强;加入催化剂;t3~t4.
| 2mol |
| 2 |
| ||
| △t |
| ||
| 2min |
| c6(CO) |
| c2(N2) |
故答案为:0.25 mol/L?min,平衡常数K=
| c6(CO) |
| c2(N2) |
(2)其它条件不变时仅增大压强,平衡向气体体积减小的方向移动,平衡常数只与温度有关,所以该反应向逆反应方向移动,温度不变平衡常数不变,故选c;
(3)a.当c(N2 ):c(CO)=1:3时,该反应不一定达到平衡状态,这与反应物浓度和转化率有关,故错误;
b.无论该反应是否达到平衡状态,都存在3v(N2 )=v(CO),故错误;
c.当固体质量不再改变时,该反应达到平衡状态,故正确;
d.当气体密度不再改变时,各物质的浓度不再改变,该反应达到平衡状态,故正确;
故选c、d;
(4)若不改变N2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为升高温度后压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂;
t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;
故答案为:升高温度后压缩体积增大压强;加入催化剂;t3~t4.
点评:考查化学平衡常数与影响因素、平衡状态判断、影响平衡移动的因素与平衡图象等,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态,为易错点.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
氮化硅(Si3N4)是一种具有耐高温、耐磨蚀等优异性能的新型陶瓷.工业上可用如下反应来制取:3SiO2+6C+2N2
Si3N4+6CO下列说法中不正确的是( )
| ||
| A、氮化硅陶瓷可用于制造汽车发动机 |
| B、氮化硅中氮元素的化合价为─3 |
| C、氮化硅陶瓷属于新型无机非金属材料 |
| D、氮化硅不会与任何酸发生反应 |
氮化硅(Si3N4)是一种新型陶瓷材料,800℃下,石英、焦炭和氮气通过以下反应可制得氮化硅.3SiO2(s)+6C(s)+2N2(g)
Si3N4(s)+6CO(g)
(1)该反应中的氧化产物是 .
(2)800℃下,该反应的平衡常数表达式K= .
(3)已知:该反应K800℃>K 850℃,则该反应是 反应.(填“放热”或“吸热”).
(4)一定温度下,在2L密闭容器内,充入一定量SiO2、C、N2进行上述反应,N2的物质的量随时间(t)的变化如下表:
从反应初到平衡时,CO的平均生成速率为v(CO)= mol/(L?min).
(5)若压缩(4)中的密闭体系,则上述平衡向 反应方向移动.(填“正”或“逆”).
(6)能使SiO2的转化率增大的措施是 .(填标号)
A.及时分离出CO气体 B.降低温度 C.增加C的初始量 D.使用适宜催化剂.
| ||
(1)该反应中的氧化产物是
(2)800℃下,该反应的平衡常数表达式K=
(3)已知:该反应K800℃>K 850℃,则该反应是
(4)一定温度下,在2L密闭容器内,充入一定量SiO2、C、N2进行上述反应,N2的物质的量随时间(t)的变化如下表:
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(N2)/mol | 2.00 | 1.40 | 1.12 | 1.00 | 1.00 | 1.00 |
(5)若压缩(4)中的密闭体系,则上述平衡向
(6)能使SiO2的转化率增大的措施是
A.及时分离出CO气体 B.降低温度 C.增加C的初始量 D.使用适宜催化剂.