网址:http://m.1010jiajiao.com/timu3_id_352278[举报]
(本题12分)化合物M是一种治疗心脏病药物的中间体,以A为原料的工业合成路线如下图所示。
已知:RONa+ R’X→ROR’+ NaX
根据题意完成下列填空:
(1)写出反应类型。反应① 反应②
(2)写出结构简式。A C
(3)写出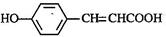 的邻位异构体分子内脱水产物香豆素的结构简式 。
的邻位异构体分子内脱水产物香豆素的结构简式 。
(4)由C生成D的另一个反应物是 ,反应条件是 。
(5)写出由D生成M的化学反应方程式 。
(6)A也是制备环己醇( )的原料,写出检验A已完全转化为环己醇的方法。
)的原料,写出检验A已完全转化为环己醇的方法。
(本题12分)化合物M是一种治疗心脏病药物的中间体,以A为原料的工业合成路线如下图所示。

已知:RONa+ R’X→ROR’+ NaX
根据题意完成下列填空:
(1)写出反应类型。反应① 反应②
(2)写出结构简式。A C
(3)写出 的邻位异构体分子内脱水产物香豆素的结构简式
。
的邻位异构体分子内脱水产物香豆素的结构简式
。
(4)由C生成D的另一个反应物是 ,反应条件是 。
(5)写出由D生成M的化学反应方程式 。
(6)A也是制备环己醇( )的原料,写出检验A已完全转化为环己醇的方法。
)的原料,写出检验A已完全转化为环己醇的方法。
查看习题详情和答案>>
(本题共12分)
以海水中常见物质A为原料可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据物质之间的转化关系回答下列问题:
(1)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为 ;
(2)写出电解A溶液的化学方程式为 ;
(3)若使工业合成J反应的平衡向生成J的方向移动,可采取的措施有 (填字母代号);
A.升高温度 B.增大压强 C.使用催化剂 D.液化分离
(4)将F和J通入A的饱合溶液中的顺序为 。
A.先通入F后通入J B.先通入J后通入F
C.同时通入 D.没有先后顺序要求
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中
NaCl的质量分数。
①检验沉淀是否洗涤干净的所用到的试剂是: ,
②样品中NaCl的质量分数的数学表达式为: 。
查看习题详情和答案>>
(12分)酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
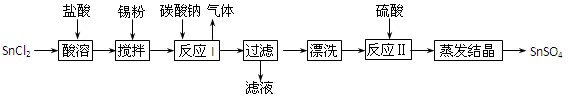
回答下列问题:
⑴SnCl2用盐酸而不用水直接溶解的原因是 ,加入Sn粉的作用是 。
⑵反应I生成的沉淀为SnO,写出该反应的化学方程式: 。
⑶检验沉淀已经“漂洗”干净的方法: 。
⑷反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol·L—1,则应控制溶液pH 。已知:Ksp[Sn(OH)2]=1.0×10—26。
⑸酸性条件下,SnSO4还可以用作双氧水去除剂,试写出发生反应的离子方程式:
。
查看习题详情和答案>>
(本题共12分)
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:

根据题意回答:
1.实验中需用0.8mol/L的硫酸800 mL,若用98%的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
A.10 mL B.20 mL C.50 mL D.100 mL
2.加入的NaClO可与Mn2+反应:Mn2+ + ClO- + H2O → MnO2↓ + 2H+ + Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
3.滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 。
4.在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法 。
5.已知MgSO4、CaSO4的溶解度如下表:
|
温度(℃) |
40 |
50 |
60 |
70 |
|
MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
|
CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 。“操作I”是将滤液继续蒸发浓缩,冷却结晶, ,便得到了MgSO4·7H2O。
6.实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,则MgSO4·7H2O的产率为 。
查看习题详情和答案>>