题目内容
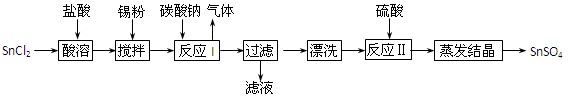
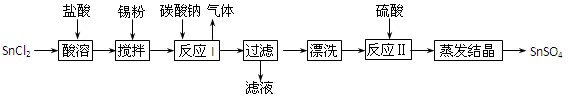
(12分)酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
⑴SnCl2用盐酸而不用水直接溶解的原因是 ,加入Sn粉的作用是 。
⑵反应I生成的沉淀为SnO,写出该反应的化学方程式: 。
⑶检验沉淀已经“漂洗”干净的方法: 。
⑷反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol·L—1,则应控制溶液pH 。已知:Ksp[Sn(OH)2]=1.0×10—26。
⑸酸性条件下,SnSO4还可以用作双氧水去除剂,试写出发生反应的离子方程式:
。
⑴抑制Sn2+水解 防止Sn2+被氧化 ⑵SnCl2+Na2CO3=SnO+CO2↑+2NaCl
⑶取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明洗涤干净
⑷小于1 ⑸2Sn2++2H2O2+4H+=2Sn4++4H2O
【解析】(1)SnCl2是强酸弱碱盐,水解显酸性,所以加入盐酸能抑制Sn2+水解。由于Sn2+易被氧化,所以加入锡能防止Sn2+被氧化 。
(2)碳酸钠水解锡碱性,所以和SnCl2反应能产生CO2。因此根据反应物和主要生成物可知,方程式为SnCl2+Na2CO3=SnO+CO2↑+2NaCl。
(3)洗涤液中如果含有氯离子,则没有洗净,所以可通过检验氯离子来检验沉淀是否洗净,即取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明洗涤干净。
(4)溶液中c(Sn2+)=1.0mol·L—1,则根据溶度积常数表达式可知,OH-的浓度是
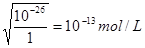 。所以应该控制溶液的pH小于1。
。所以应该控制溶液的pH小于1。
(5)SnSO4被双氧水氧化生成Sn4+,而还原产物是水,所以方程式为
2Sn2++2H2O2+4H+=2Sn4++4H2O。

(15分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下还原法,在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 。
(2)还原+6价铬还可选用以下的 试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
在操作②中调节pH应分2次进行,第1次应先调节溶液的pH范围约在 (填序号)最佳,第2次应调节溶液的pH范围约在 (填序号)最佳
A.3~4 B.6~8 C.10~11 D.12~14
用于调节溶液的最佳试剂为: (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH