网址:http://m.1010jiajiao.com/timu3_id_352181[举报]
①石蕊试纸(检验气体):。?
②滴定管: 。?
③集气瓶(收集氨气): 。?
④托盘天平 。?
(Ⅱ)目前国际油价居高不下。乙醇汽油是指在汽油中加入10%的乙醇(体积比)。乙醇汽油具有辛烷值高、抗爆性好的特点,推广使用可缓解能源紧缺、促进国民经济发展。汽油中添加的乙醇不能含水,否则会影响发动机正常运转和使用寿命。制备无水乙醇可采取如下方法:??
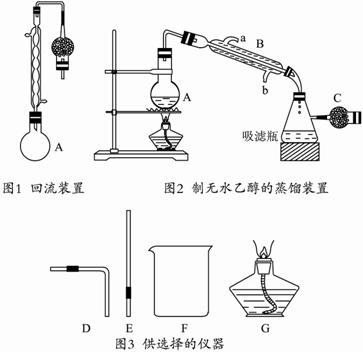
①在250 mL圆底烧瓶中加入95%的乙醇100 mL和新制的生石灰30 g,在水浴中加热回流1至2小时。(如图1所示)?
②取下冷凝管,改成如图2所示的装置,再将A置于水浴中蒸馏。?
③把最初蒸出的5 mL馏出液另外回收。?
④用烘干的吸滤瓶作为接受器,其侧管接一支装有CaCl2的干燥管C,使其与大气相通,蒸至无液滴出来为止,即得99.5%的酒精。试回答:?
(1)已知在101 kPa、25 ℃时,?
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);ΔH =-1 367 kJ·mol-1??
1 g乙醇完全燃烧生成液态水时放出 热量。?
(2)图2中的干燥管C的作用是 。仪器B的名称是 ,冷凝水是从口 (填“a”或“b”)进入冷凝管。?
(3)无水CaCl2常用作吸水剂,在烧瓶A中能否用无水CaCl2代替生石灰? (填写“能”“不能”),原因是 。?
(4)检验所得产品中是否含水的操作方法是 。
(5)某同学想要检验图2装置的气密性,他可从图3中选择哪几种仪器(填仪器代号) 。请简述检验气密性的操作过程 。?
(6)写出由葡萄糖转化为酒精的化学方程式: 。?
查看习题详情和答案>> (2010?郑州一模)如图所示,一定条件下将1mol A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示.在恒温恒压下发生如下反应:A2+3B2?2AB3.当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率是( )
(2010?郑州一模)如图所示,一定条件下将1mol A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示.在恒温恒压下发生如下反应:A2+3B2?2AB3.当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率是( )(1)写出基态Mn原子的核外电子排布式
(2)CoTiO3晶体结构模型如图1所示.在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数目分别为
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理.O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2.与CNO-互为等电子体的分子、离子化学式分别为
(4)三聚氰胺是一种含氮化合物,其结构简式如图2所示.

三聚氰胺分子中氮原子轨道杂化类型是
(1)请写出炉气制造即沸腾炉中黄铁矿燃烧的化学方程式
| ||
| ||
 (2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
(2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.A、精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如图1所示.在实际生产中,SO2催化氧化反应的条件选择常压、450℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是
B、接触室中2SO2(g)+O2(g)
| ||
| △ |
已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:

①图中C点表示
②反应达到平衡时,平衡常数表达式K=
| c2(SO3) |
| c2(SO2)c(O2) |
| c2(SO3) |
| c2(SO2)c(O2) |
(3)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物.取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收.实验数据如下:
| 实验次数 | 铵盐质量(g) | 浓硫酸增加的质量(g) |
| 第一次 | 1.570 | 0.340 |
| 第二次 | 3.140 | 0.680 |
| 第三次 | 4.710 | 0.510 |
| 第四次 | 6.280 | 0 |
②x的值为
(1)如图1所示,在电场中利用膜技术(阳离子交换膜只允许阳离子通过,阴离子交换摸只允许阴离子通过)淡化海水,该方法称为电渗析法.
①图中膜a应选用
②电渗析法还可用来处理电镀废液,写出用该方法处理含硝酸银废液时所发生反应的化学方程式

(2)从卤水中提取镁的步骤为:
a将海边大量存在的贝壳煅烧成石灰并将石灰制成石灰乳
b将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀
c在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液再经蒸发结晶得到MgCl2?6H2O
d将MgCl2?6H2O在一定条件下加热得到无水MgC12
e电解熔融的氯化镁可得到Mg.
①步骤d中的“一定条件”指的是
②有同学认为步骤b后可加热Mg(OH)2得到MgO再电解熔融的MgO制金属镁这样可简化实验步骤体现实验的简约性原则.你同意该同学的想法吗?为什么?
(3)利用H2S、HDS、H2O和HDO四种物质,在25利℃和100℃两种不同的温度下发生的两个不同反应得到较高浓度的HDO.图2为“硫化氢-水双温交换法”所发生的两个反应中涉及的四种物质在反应体系中的物质的量随温度的变化曲线.写出100℃时所发生反应的化学方程式