摘要:(1)4Mg+SiO2 △ Mg2Si+2MgO 放热 (2)SiH4 (3)SiH4+2O2=SiO2+2H2O
网址:http://m.1010jiajiao.com/timu3_id_351879[举报]
设NA为阿伏加德罗常数,则下列说法正确的是
A.1 mol SiO![]() 晶体中含有Si―O键2NA
晶体中含有Si―O键2NA
B.标准状况下,22.4 L己烯中含有的分子数为NA
C.1 mol HCHO与足量银氨溶液反应,转移电子数为4NA
D.用含1 mol FeCl3的溶液制得Fe(OH)![]() 。胶体粒子数为NA.
。胶体粒子数为NA.![]()
C和Si元素在化学中占有极其重要的地位.
(1)写出Si的基态原子核外电子排布式
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
(3)氧化物MO的电子总数与SiC的相等,则M为
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π健.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π健
(5)有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键;B的分子也属于非极性分子,但既有非极性键,又有极性键;C的分子属于极性分子.则可推出:A的电子式是
 ,B的结构式是
,B的结构式是
(6)已知Si-Si键能为176kJ/mol,Si-O键能为460kJ/mol,O=O键能为497.3kJ/mol.则可计算出1mol硅与足量氧气反应时将放出
查看习题详情和答案>>
(1)写出Si的基态原子核外电子排布式
1s22s22p63s23p2
1s22s22p63s23p2
.从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为O>C>Si
O>C>Si
.(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
sp3
sp3
,微粒间存在的作用力是共价键
共价键
.(3)氧化物MO的电子总数与SiC的相等,则M为
Mg
Mg
(填元素符号),MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MO的熔点比CaO的高,其原因是Ca2+的离子半径大于Mg2+,MgO的晶格能大
Ca2+的离子半径大于Mg2+,MgO的晶格能大
.(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π健.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π健
Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
.(5)有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键;B的分子也属于非极性分子,但既有非极性键,又有极性键;C的分子属于极性分子.则可推出:A的电子式是


H-C≡C-H
H-C≡C-H
.(6)已知Si-Si键能为176kJ/mol,Si-O键能为460kJ/mol,O=O键能为497.3kJ/mol.则可计算出1mol硅与足量氧气反应时将放出
=-990.7
=-990.7
kJ的热量.人类的衣食住行都离不开化学,下列问题请回答(填字母):
(1)含氟牙膏中的氟应理解为
(2)铁强化酱油中铁元素的作用
(3)加碘食盐中碘主要以碘酸钾形式存在,其中碘的化合价是
(4)称取50.0g食盐配成溶液,加入KI与稀H2SO4,其化学方程式KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,实验中,若测得生成
3.0×10-5mol I2,则该食盐中碘元素的含量是
查看习题详情和答案>>
(1)含氟牙膏中的氟应理解为
b
b
(a:单质; b:元素)(2)铁强化酱油中铁元素的作用
b
b
(a:增强味道; b:预防缺铁性贫血; c:补充人体需要的铁元素)(3)加碘食盐中碘主要以碘酸钾形式存在,其中碘的化合价是
+5
+5
(4)称取50.0g食盐配成溶液,加入KI与稀H2SO4,其化学方程式KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,实验中,若测得生成
3.0×10-5mol I2,则该食盐中碘元素的含量是
25.4
25.4
mg/kg(精确到0.1)[化学-选修3:物质结构与性质]
硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为
(2)硅主要以硅酸盐、
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是
②SiH4的稳定性小于CH4,更易生成氧化物,原因是
(6)在硅酸盐中,SiO
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
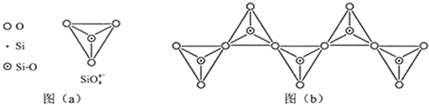
查看习题详情和答案>>
硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为
M
M
,该能层具有的原子轨道数为9
9
、电子数为4
4
.(2)硅主要以硅酸盐、
二氧化硅
二氧化硅
等化合物的形式存在于地壳中.(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以
共价键
共价键
相结合,其晶胞中共有8个原子,其中在面心位置贡献3
3
个原子.(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为
Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2
Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2
.(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ?mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
.②SiH4的稳定性小于CH4,更易生成氧化物,原因是
C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键
C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键
.(6)在硅酸盐中,SiO
4- 4 |
sp3
sp3
,Si与O的原子数之比为1:3
1:3
,化学式为SiO32-
SiO32-
.
 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中元素T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中元素T所处的周期序数与主族序数相等,请回答下列问题:(1)Q的最高价氧化物的电子式为


(2)元素的非金属性为:Q
弱于
弱于
W(填“强于”或“弱于”).(3)R的最高价氧化物的水化物的浓溶液能能与镁发生反应,其中R被还原到最低价,则反应的化学方程式为
4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
.(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(5)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是
NaNO2
NaNO2
.