网址:http://m.1010jiajiao.com/timu3_id_351861[举报]
草酸晶体的组成可表示为H2C2O4?xH2O,为测定x的值进行下述实验。
A.称取mg纯草酸晶体,将其配成100mL溶液作为待测液。
B.取25mL待测液置于锥形瓶中,再加入适量的稀H2SO4,用浓度为amol/L的KMnO4溶液滴定,滴定所发生的反应为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
试回答:
(1)实验A欲配制准确浓度的草酸待测液,必须使用的仪器是_______。
(2)用KMnO4溶液进行滴定时,KMnO4溶液应装在______中,操作时用______手拿锥形瓶。
(3)若滴定时所用的KMnO4溶液因久置而浓度变小,则所测定的x值将_______。
(4)假定滴定中共用去KMnO4溶液VmL,则待测草酸溶液的物质的量浓度为______,由此计算出草酸晶体中结晶水x的值为_______。
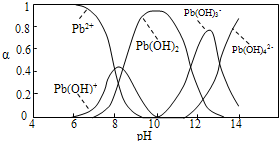
(1)Pb(NO3)2溶液中,
| c(Pb2+) |
| c(NO3-) |
| 1 |
| 2 |
(2)向Pb(NO3)2溶液中滴加NaOH溶液,溶液变浑浊,在pH约为
(3)水中铅含量检测:
①配制Pb2+浓度为1.0mg/mL的标准溶液100mL.称取
a.容量瓶 b.精确度为0.001g的电子天平 c.精确度为0.1mg的电子天平
②将上述溶液稀释为浓度分别为0.2、1.0、3.0、5.0、7.0、10.0(单位:mg/L)的溶液.稀释时需先加硝酸,然后再加水,这样操作的原因是
③向步骤②配制的各浓度溶液中加入显色剂后,分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如下.
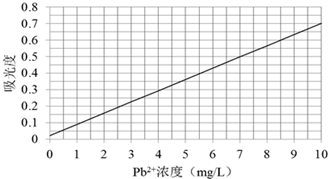
④取某工厂的未经处理的废水水样10mL,稀释至100mL,按步骤③的方法进行测定,两次测定所得的吸光度数据分别为0.490、0.510,则该工厂废水中所含Pb2+浓度为
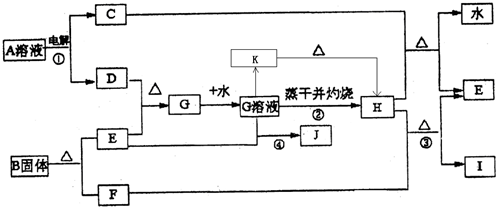
(1)反应①阳极的电极反应式
(2)反应③的化学方程式
| ||
| ||
(3)反应④的离子方程式为
(4)K是一种难溶于水的固体,K受热分解可生成H.实现由G溶液到K的转化时可以加入的试剂是(填写选项字母)
A.NaOH溶液 B.氨水 C.Na2CO3溶液 D.NaHCO3溶液
(5)将G的饱和溶液加入到沸水中,继续加热可得红褐色液体,写出反应的离子方程式:
(6)若E中含有合金元素,会导致G不纯.测定G的质量分数通常可用碘量法测定:称取mg无水G样品,溶于稀盐酸,再转移
 到
到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol?L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去VmL.(杂质不参与反应)则样品中G的质量分数为:
| 162.5Vc |
| m |
| 162.5Vc |
| m |
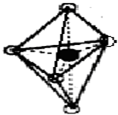
(7)B的结构为三角双锥(如图所示),图中○代表F分子,●代表E原子.则B的化学式为
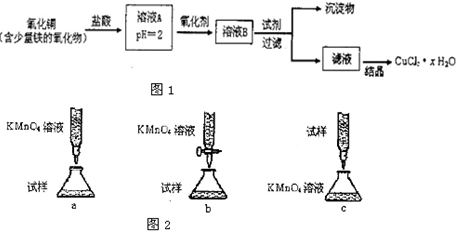
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解.
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+.检验溶液A中Fe2+的最佳试剂为
①KMnO4 ②(NH4)2S ③NaOH ④KSCN
(2)氧化剂可选用
①Cl2 ②KMnO4 ③HNO3 ④H2O2
(3)要得到较纯的产品,试剂可选用
①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mol,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需
(6)为了测定制得的氯化铜晶体中CuCl2xH2O中x的值,某兴趣小组设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1g.
方案二:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为n2g. 试评价上述两种实验方案:其中正确的方案是
| 80m-135n2 |
| 18n2 |
| 80m-135n2 |
| 18n2 |
已知:E为常见金属单质,C、D、F、I均为常见气体,其中C、D为单质,F、I为化合物,且组成元素相同,D、F有毒,I为直线型非极性分子,它们有如下框图关系:
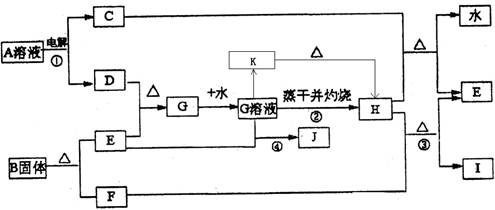
(1)反应①阳极的电极反应式 。
(2)反应③的化学方程式 ,
(3)反应④的离子方程式为 。
(4)K是一种难溶于水的固体,K受热分解可生成H。实现由G溶液到K的转化时可以加入的试剂是(填写选项字母)
A.NaOH溶液 B.氨水 C.Na2CO3溶液 D.NaHCO3溶液
(5)将G的饱和溶液加入到沸水中,继续加热可得红褐色液体,写出反应的离子方程式:
该液体接通直流电后___ __极附近颜色加深,这种过程叫做____ _。
(6)若E中含有合金元素,会导致G不纯。测定G的质量分数通常可用碘量法测定:称取mg无水G样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I- +S4O62-),共用去VmL。(杂质不参与反应)则样品中G的质量分数为: 。
查看习题详情和答案>>