网址:http://m.1010jiajiao.com/timu3_id_351809[举报]
下图是用0.1000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
⑴ 仪器A的名称是 ;
⑵ 盐酸的体积读数:滴定前读数为 mL,滴定后读数为 mL 。
⑶ 某实验小组同学的三次实验的实验数据如下表所示。 根据表中数据计算出的待测NaOH溶液的平均浓度是 mol/L。(保留四位有效数字)
| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
⑷ 滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00 mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)________
⑸用标准盐酸滴定待测烧碱溶液,滴定时____手旋转酸式滴定管的 ,_______手不停地向同一方向摇动锥形瓶,两眼注视 ,直到 为止,可判断滴定到达终点。
查看习题详情和答案>>
下图是用0.1000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
⑴ 仪器A的名称是 ;
⑵ 盐酸的体积读数:滴定前读数为 mL,滴定后读数为 mL 。
⑶ 某实验小组同学的三次实验的实验数据如下表所示。 根据表中数据计算出的待测NaOH溶液的平均浓度是 mol/L。(保留四位有效数字)


|
实验 编号 |
待测NaOH溶液的体积(mL) |
滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
|
1 |
20.00 |
1.20 |
23.22 |
|
2 |
20.00 |
2.21 |
24.21 |
|
3 |
20.00 |
1.50 |
23.48 |
⑷ 滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00 mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)________
⑸用标准盐酸滴定待测烧碱溶液,滴定时____手旋转酸式滴定管的 ,_______手不停地向同一方向摇动锥形瓶,两眼注视 ,直到 为止,可判断滴定到达终点。
查看习题详情和答案>>

请回答:
(1)仪器A的名称是
(2)请你将滴定前、后盐酸的体积读数填入后面的空格:滴定前为
(3)某实验小组同学的三次实验的实验数据如下表所示.根据表中数据计算出的待测NaOH溶液的平均浓度是
| 实验编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的体积读数(mL) | 滴定后盐酸的体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCl溶液滴定终点并记下滴定管液面的刻度.
正确操作步骤的顺序是(用序号字母填写)
(5)判断到达滴定终点的实验现象是
(6)如果上述B步骤省略,则对测定结果的影响是
(1)甲醛溶液可用于浸制生物标本,这主要是利用了甲醛的何种化学性质
(2)由生物质能获得的CO和H2,可以合成多种有机物.当CO和H2以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得
反应达到平衡时的有关数据如下:
| 1.容器 | 2.甲 | 3.乙 | 4.丙 |
| 5.反应物投入量 | 6.1molCO、2molH2 | 7.l molCH3OH | 8.2molCO、4molH2 |
| 9.CH30H昀浓度(mol/L) | 10.cl | 11.c2 | 12.c3 |
| 13.反应的能量变化 | 14.放出Q1kJ | 15.吸收Q2kJ | 16.放出Q3kJ |
| 17.平衡常数 | 18.Kl | 19.K2 | 20.K3 |
| 21.反应物转化率 | 22.al | 23.a2 | 24.a3 |
A.cl=c2 B.2Q1=Q3 C.KI=K3 D.a2+a3<100%
(4)一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2 (g)+3CO (g) CH3OCH3 (g)+CO2(g)
若一体积可变的密闭容器中充入3mol H2、3molCO、l mol CH3OCH3、l mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍.平衡时
n(CH3OCH3)=
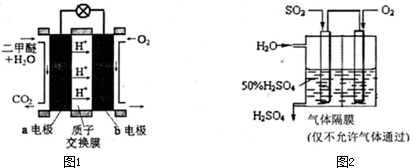
(5)如图1为绿色电源“直接二甲醚燃料电池”的工作原理示意图.b电极是
(6)利用生物质资源过程中会产生SO2,可利用如图2所示装置,用电化学原理生产硫酸为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为
 如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:(1)仪器A的名称是
(2)盐酸的体积读数:
滴定前读数为
(3)某实验小组同学的三次实验的实验数据如下表所示.根据表中数据计算出的待测NaOH溶液的浓度是
| 实验 编号 |
待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度.
正确操作步骤的顺序是(用序号字母填写)
(5)判断到达滴定终点的实验现象是
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果上述B步骤省略,对测定结果的影响是
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失.
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是