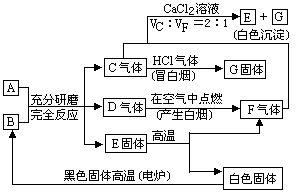
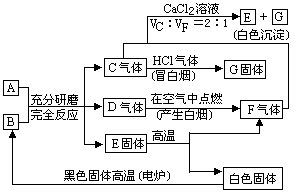
摘要:潮湿的酸式盐A与化合物B在研钵里混合研磨时.会生成C.D两种气体和固体E,C遇浓盐酸时冒白烟,D在空气中燃烧时产生浓烟且有一种生成物与E在高温下分解的气体产物F相同,C与F混合后通入CaCl2溶液中会生成E.请填写下列空白: (1)A B (2)潮湿的A与B混合研磨的反应式 (3)C与F混合通入CaCl2的反应离子方程式
网址:http://m.1010jiajiao.com/timu3_id_351791[举报]
| |||||||||||||||
| |||||||||||||||
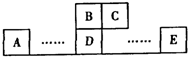 如图为元素周期表中的一部分,A、B、C、D、E均为短周期主族元素,B元素原子的最外层有4个电子,E原子最外层电子数与C的原子序数相等.回答下列问题:
如图为元素周期表中的一部分,A、B、C、D、E均为短周期主族元素,B元素原子的最外层有4个电子,E原子最外层电子数与C的原子序数相等.回答下列问题:(1)B、D形成的化合物甲,C、D形成的化合物乙,二者晶体结构均为空间网状结构,则其晶体类型为
原子晶体
原子晶体
;乙的化学式为Si3N4
Si3N4
.(2)B、D分别可与E形成化合物丙、丁,丙属于
非极性
非极性
(填“非极性”或“极性”)分子,试将甲、乙、丙、丁四种物质按熔点由高到低的顺序排列:Si3N4>SiC>SiCl4>CCl4
Si3N4>SiC>SiCl4>CCl4
.(用化学式表示)(3)B和C元素形成的物质(BC)2可称为拟卤素,写出该物质与NaOH溶液反应的离子方程式
(CN)2+2OH-=CN-+CNO-+H2O
(CN)2+2OH-=CN-+CNO-+H2O
.(4)C、E形成的分子的空间构型为三角锥形,分子中各原子最外层均达8电子稳定结构,该物质在潮湿的空气中与水蒸气能发生氧化还原反应,生成含C的无色氧化物气体、C的最高价含氧酸及E的氢化物,写出该反应的化学方程式
3NCl3+5H2O=2NO+HNO3+9HCl
3NCl3+5H2O=2NO+HNO3+9HCl
.三氟化氮(NF3)在微电子工业中有重要用途,可由氨气和氟气反应得到,它在潮湿的空气中与水蒸气反应的产物有HF、NO和HNO3.下列说法错误的是( )
| A、原子半径:N>F | B、在与水蒸气反应中,NF3既是氧化剂又是还原剂 | C、若NF3泄漏,可用石灰水溶液喷淋的方法减少污染 | D、在潮湿空气中反应,被氧化与被还原的元素的物质的量之比为2:1 |