网址:http://m.1010jiajiao.com/timu3_id_351697[举报]
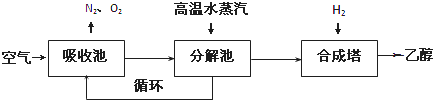
吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变为可再生燃料乙醇.回答下列问题:
(1)写出吸收池中反应的离子方程式______.
(2)从分解池中循环使用的物质是______.
(3)工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)写出该反应的化学平衡常数表达式K=______.
(4)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数.则由CO制取CH3CH2OH相比由CO2制备CH3CH2OH的优点是______(写出一点即可);
(5)已知:一定条件下,2.0g乙醇完全燃烧生成液态水放出59.43kJ的热量,在该条件下:
①写出表示乙醇燃烧热的热化学方程式______.②若以乙醇作燃料,KOH作电解质,构成燃料电池,请写出负极的电极方程式:______.
(6)在一定压强下,测得由CO2制取CH3CH2OH的实验数据如下表:
| 温度(K) CO2转化率% n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
温度升高,该反应的平衡常数K值______(选填“增大”、“减小”或“不变”);
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]()
②CO(g)+H2O(g)=CO2(g)+H2(g) ![]()
写出由二氧化碳、氢气制备甲醇的热化学方程式 ;
(2)在压强0.1MPa条件下,容积为 VL的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。

①P1 P2(填大于、小于或等于);
②在其它条件不变的情况下,再增加 amolCO与2amolH2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”,下 同),平衡常数 。
(3)以甲醇为燃料的新型燃料电池,正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:CH3OH+H2O-6e-=CO2+6H+
①正极的电极反应式是 ;放电时,H+移向电池的 (填“正”或“负”)极。
②若以该燃料电池作为电源,用石墨作电极电解500mL饱和食盐水,当两极共收集到标准状况下的气体1.12L(不考虑气体的溶解)时,所得溶液的pH= (假设反应前后溶液体积不变)。
查看习题详情和答案>>甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]()
②CO(g)+H2O(g)=CO2(g)+H2(g) ![]()
写出由二氧化碳、氢气制备甲醇的热化学方程式 ;
(2)在压强0.1MPa条件下,容积为 VL的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①P1 P2(填大于、小于或等于);
②在其它条件不变的情况下,再增加 amolCO与2amolH2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”,下同),平衡常数 。
(3)以甲醇为燃料的新型燃料电池,正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:CH3OH+H2O-6e-=CO2+6H+
①正极的电极反应式是 ;放电时,H+移向电池的 (填“正”或“负”)极。
②若以该燃料电池作为电源,用石墨作电极电解500mL饱和食盐水,当两极共收集到标准状况下的气体1.12L(不考虑气体的溶解)时,所得溶液的pH= (假设反应前后溶液体积不变)。
查看习题详情和答案>>
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)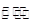 CH3OH(g)
CH3OH(g) 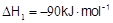
②CO(g)+H2O(g)=CO2(g)+H2(g)

写出由二氧化碳、氢气制备甲醇的热化学方程式 ;
(2)在压强0.1MPa条件下,容积为 VL的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
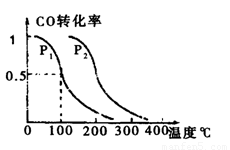
①P1 P2(填大于、小于或等于);
②在其它条件不变的情况下,再增加 amolCO与2amolH2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”,下 同),平衡常数 。
(3)以甲醇为燃料的新型燃料电池,正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:CH3OH+H2O-6e-=CO2+6H+
①正极的电极反应式是 ;放电时,H+移向电池的 (填“正”或“负”)极。
②若以该燃料电池作为电源,用石墨作电极电解500mL饱和食盐水,当两极共收集到标准状况下的气体1.12L(不考虑气体的溶解)时,所得溶液的pH= (假设反应前后溶液体积不变)。
查看习题详情和答案>>
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(l)已知在常温常压下反应的热化学方程式:
① CO ( g ) + 2H2(g)= CH3OH ( g ) △H1 = -90 kJ · mol-1
② CO ( g ) + H2O ( g ) = CO2 ( g ) + H2 ( g ) △H2= -41 kJ · mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:
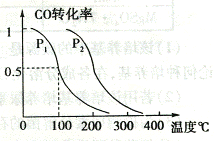 (2)在压强为0.1MPa 条件下.容积为VL 的容器中充入a mol CO 与2a mo1H2 在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示;
(2)在压强为0.1MPa 条件下.容积为VL 的容器中充入a mol CO 与2a mo1H2 在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示;
① P1 P2 (填大于、小于或等于);
② 在其它条件不变的情况下,再增加a mol CO 与2a mo1H2 ,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”,下同),平衡常数 。
(3)以甲醇为燃料的新型燃料电池,正极通入O2 ,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:CH3OH + H2O-6e- = CO2 + 6H+
① 正极的电极反应式是 ;放电时,H+移向电池的 (填“正”或“负”)极;
② 若以该燃料电池作为电源,用石墨作电极电解500mL 饱和食盐水,当两极共收集到标准状况下的气体1.12 L(以不考虑气体的溶解)时,所得溶液的pH = (假设反应前后溶液体积不变)。