摘要:3.26g液态酯CnH2n+1C-OCH2CnH2n+1.用25.0ml, 2mol/L NaOH溶液进行回流. O 溶液回流后.为完全中和.需用盐酸26.0ml.0.5mol·L-1.则n的值是( ) A.0 B.1 C.2 D.3
网址:http://m.1010jiajiao.com/timu3_id_351570[举报]
将3.26g液态酯RCOOCH2R(其中R代表CnH2n+1的烃基)用25.0mL 2mol/LNaOH溶液进行回流。溶液回流后,为完全中和需26.0mL0.5 mol/L盐酸,则 n值是
A.0
B.1
C.2
D.3
查看习题详情和答案>>将3.26g液态酯RCOOCH2R(其中R代表CnH2n+1的烃基)用25.0mL 2mol/LNaOH溶液进行回流。溶液回流后,为完全中和需26.0mL0.5 mol/L盐酸,则n值是
- A.0
- B.1
- C.2
- D.3
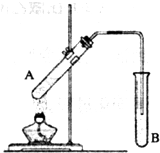 实验室用右图所示装置制取乙酸乙酯.
实验室用右图所示装置制取乙酸乙酯.(1)A试管中加入碎瓷片的目的是
防止液体暴沸
防止液体暴沸
;B试管内盛装的溶液是
饱和碳酸钠溶液
饱和碳酸钠溶液
,其作用有降低乙酸乙酯在水中溶解度,易于分层
降低乙酸乙酯在水中溶解度,易于分层
,吸收随乙酸乙酯挥发出的乙酸,溶解乙酸乙酯中混有的乙醇.
吸收随乙酸乙酯挥发出的乙酸,溶解乙酸乙酯中混有的乙醇.
(2)实验前向B试管中加入一滴酚酞试液,实验过程中观察到溶液的红色逐渐变浅,其原因是
挥发出的乙酸与碳酸钠反应,导致溶液的碱性逐渐减弱
挥发出的乙酸与碳酸钠反应,导致溶液的碱性逐渐减弱
.实验中注意长导管不能伸到B试管液面下,原因是防止B试管中溶液倒吸入A试管中
防止B试管中溶液倒吸入A试管中
删除此空
删除此空
(3)将生成的乙酸乙酯分离出来的实验操作是
分液
分液
,所需要的主要仪器是分液漏斗
分液漏斗
(4)与乙醇和乙酸在浓硫酸催化作用下发生酯化反应相似,某酸和某醇也能发生酯化反应生成酯Cn+3H2n+6O2,若某酸表示为CnH2nO2,则某醇化学式为
C3H8O
C3H8O
.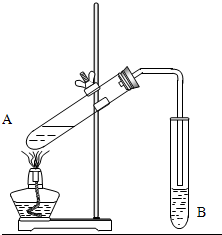 实验室用如图制取乙酸乙酯.
实验室用如图制取乙酸乙酯.(1)A试管中反应方程式为
(2)实验前向B试管中加入一滴酚酞试液,实验过程中观察到溶液的红色逐渐变浅,其原因是
(3)将生成的乙酸乙酯分离出来的实验操作是
(4)与乙醇和乙酸在浓硫酸催化作用下发生酯化反应相似,某酸和某醇也能发生酯化反应生成酯Cn+2H2n+4O2,若某酸表示为CnH2nO2,则某醇化学式为
氮元素可形成多种离子,如N3-、N3-、NH2-、NH4+、N2H5+、N2H62+等.
(1)与N相邻的两种元素C、O,三者第一电离能由大到小为
(2)N≡N的键能为942kJ?mol-1,N-N单键的键能为247kJ?mol-1,说明N2中的
(3)液态氨可电离出NH2-.NH2-的电子式为
 .
.
(4)已知NH4H为离子化合物,写出其与重水D2O反应的生成物(加热)
(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图1所示.与同一个N3-相连的X+有
(6)最近科学家研制出某元素Z与N元素形成的晶体ZN,已知ZN晶体具有与NaCl相似的晶体结构.图2是从ZN晶体结构图中分割出来的部分结构图,试判断符合ZN晶体结构图的是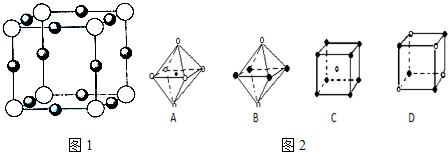
查看习题详情和答案>>
(1)与N相邻的两种元素C、O,三者第一电离能由大到小为
N>O>C
N>O>C
(2)N≡N的键能为942kJ?mol-1,N-N单键的键能为247kJ?mol-1,说明N2中的
π
π
键比σ
σ
键稳定(填“σ”或“π”).(3)液态氨可电离出NH2-.NH2-的电子式为


(4)已知NH4H为离子化合物,写出其与重水D2O反应的生成物(加热)
HD、NH3、HDO
HD、NH3、HDO
;Na3N也为离子化合物,则Na3N与水反应的化学方程式为Na3N+3H2O=NH3↑+3NaOH
Na3N+3H2O=NH3↑+3NaOH
,反应类型为水解反应
水解反应
.(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图1所示.与同一个N3-相连的X+有
6
6
个.X原子的基态电子排布式为1s22s22p63s23p63d104S1
1s22s22p63s23p63d104S1
(6)最近科学家研制出某元素Z与N元素形成的晶体ZN,已知ZN晶体具有与NaCl相似的晶体结构.图2是从ZN晶体结构图中分割出来的部分结构图,试判断符合ZN晶体结构图的是
AD
AD
.