摘要:掌握有关原子量.分子量以及确定分子式的计算.
网址:http://m.1010jiajiao.com/timu3_id_351544[举报]
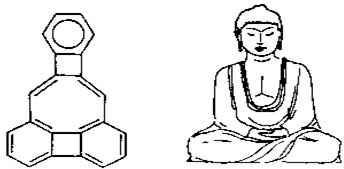
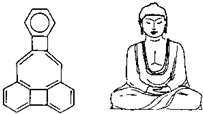 美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机物分子,就像一尊释迦牟尼佛.因而称为释迦牟尼分子(所有原子在同一平面).有关该有机物分子的说法不正确的是( )
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机物分子,就像一尊释迦牟尼佛.因而称为释迦牟尼分子(所有原子在同一平面).有关该有机物分子的说法不正确的是( )| A、该有机物属于苯的同系物 | B、该有机物属于芳香族化合物 | C、1mol该有机物最多可与11 molH2发生加成反应 | D、该有机物一溴代物只有5种 |
如图为长式周期表的一部分,其中的编号代表对应的元素.
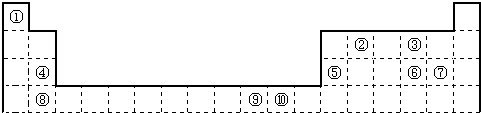
(1)表中属于ds区的元素是 (填编号).
(2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨.有关该化合物分子的说法不正确的是 .
A.分子中含极性共价键 B.含有2个σ键和2个π键
C.属于非极性分子 D.该化合物分子中,②原子采用sp2杂化
(3)根据上述表格中的十种元素填空:
Ⅰ、金属性最强的主族元素的电子排布式为 ;
Ⅱ、⑤、⑥、⑦的离子半径由小到大的顺序是 (填化学式)
Ⅲ、⑥、⑦两种元素的最高价氧化物对应的水化物的酸性由大到小的顺序是 (填化学式)
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X的空间构型为 .
查看习题详情和答案>>

(1)表中属于ds区的元素是
(2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨.有关该化合物分子的说法不正确的是
A.分子中含极性共价键 B.含有2个σ键和2个π键
C.属于非极性分子 D.该化合物分子中,②原子采用sp2杂化
(3)根据上述表格中的十种元素填空:
Ⅰ、金属性最强的主族元素的电子排布式为
Ⅱ、⑤、⑥、⑦的离子半径由小到大的顺序是
Ⅲ、⑥、⑦两种元素的最高价氧化物对应的水化物的酸性由大到小的顺序是
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为
如表为长式周期表的一部分,其中编号代表对应的元素.
(1)元素②、③、④的第一电离能由小到大顺序(用元素符号表示) ;元素⑦基态原子的外围电子排布式 .
(2)元素①、②的一种化合物是重要的化工原料,常把该化合物的产量作为衡量石油化工发展水平的标志.有关该化合物分子说法正确的是 .
A.所有原子不可能在同一平面内 B.属于非极性分子
C.含有4个σ键和1个π键 D.是石油裂解气的主要成分
(3)元素④与⑤可形成一种淡黄色的固体化合物,其晶体类型是 ;写出该物质与水反应的化学反应方程式 .
(4)在测定元素③与④所形成的一种红棕色气体化合物相对分子质量时,实验测得的值一般高于理论值的主要原因是 .
(5)在25℃、101kPa下,已知⑥简单的气态氢化物在氧气中完全燃烧后恢复至原状态,每转移1mol e-放热190.0kJ,该气态氢化物燃烧热△H= .
查看习题详情和答案>>
| ① | ||||||||||||||||||
| ② | ③ | ④ | ||||||||||||||||
| ⑤ | ⑥ | |||||||||||||||||
| ⑦ | ||||||||||||||||||
(2)元素①、②的一种化合物是重要的化工原料,常把该化合物的产量作为衡量石油化工发展水平的标志.有关该化合物分子说法正确的是
A.所有原子不可能在同一平面内 B.属于非极性分子
C.含有4个σ键和1个π键 D.是石油裂解气的主要成分
(3)元素④与⑤可形成一种淡黄色的固体化合物,其晶体类型是
(4)在测定元素③与④所形成的一种红棕色气体化合物相对分子质量时,实验测得的值一般高于理论值的主要原因是
(5)在25℃、101kPa下,已知⑥简单的气态氢化物在氧气中完全燃烧后恢复至原状态,每转移1mol e-放热190.0kJ,该气态氢化物燃烧热△H=
 正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构.层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )
正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构.层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )