摘要: 在 中燃烧呈苍白色火焰. (答案:H2.Cl2)
网址:http://m.1010jiajiao.com/timu3_id_351381[举报]
今有A、B、C、D四种元素,已知A元素是自然界中含量最多的元素;B元素为金属元素,它的原子核外K、L层电子数之和等于M、N层电子数之和;C元素的单质及其化合物的焰色反应都显黄色;氢气在D元素单质中燃烧呈苍白色。
(1)试推断并写出A、B、C、D四种元素的名称和符号。
(2)写出上述元素两两化合而成的化合物的化学式。
查看习题详情和答案>>
今有A、B、C、D四种元素,已知A元素是自然界中含量最多的元素;B元素为金属元素,它的原子核外K、L层电子数之和等于M、N层电子数之和;C元素的单质及其化合物的焰色反应都显黄色;氢气在D元素单质中燃烧呈苍白色。
(1)试推断并写出A、B、C、D四种元素的名称和符号。
(2)写出上述元素两两化合而成的化合物的化学式。
查看习题详情和答案>>有A、B、C、D、E、F、G、H等常见物质,已知有如下图转化关系,其中B、C 为常见非金属单质;F为常见金属单质;B在C中燃烧时,火焰呈苍白色;A和D的焰色反应为黄色.G和D溶液混和,产生红褐色沉淀.

(1)反应(1)中若生成0.1mol B,则转移的电子的物质的量为
(2)图中所示的5个反应中属于氧化还原反应的有:
查看习题详情和答案>>

(1)反应(1)中若生成0.1mol B,则转移的电子的物质的量为
0.2mol
0.2mol
.写出C与F反应的化学方程式2Fe+3Cl2
2FeCl3
| ||
2Fe+3Cl2
2FeCl3
.(注明反应条件)
| ||
(2)图中所示的5个反应中属于氧化还原反应的有:
(1)、(2)、(3)、(4)、(5)
(1)、(2)、(3)、(4)、(5)
.(填写编号)已知A、B、C、D均为气体,其中气体A、B为单质且A气体常温下呈黄绿色,A在B中燃烧的火焰呈苍白色,D气体的水溶液呈碱性,F溶液俗称石灰水,反应②中两气体相遇有大量白烟,G为氯化钙,它们之间的转化关系如图所示:

(1)写出A、B、D的化学式:A
(2)D气体水溶液的电离方程式:
(3)在反应①~③中,属于氧化还原反应的是
(4)反应②的化学方程式为:
查看习题详情和答案>>

(1)写出A、B、D的化学式:A
Cl2
Cl2
,BH2
H2
,DNH3
NH3
.化合物D、H均含10电子,写出同含10电子的阳离子化学式NH4+、H3O+
NH4+、H3O+
.(2)D气体水溶液的电离方程式:
NH3.H2O?NH4++OH-
NH3.H2O?NH4++OH-
;E的水解反应离子方程式:NH4++H2O?NH3.H2O+H+
NH4++H2O?NH3.H2O+H+
.(3)在反应①~③中,属于氧化还原反应的是
①
①
.(4)反应②的化学方程式为:
HCl+NH3═NH4Cl
HCl+NH3═NH4Cl
;反应③的化学方程式为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
| ||
Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
.
| ||
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀.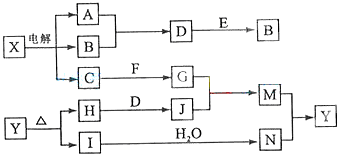
请回答下列问题:
(1)B中所含元素位于周期表中
 .
.
(2)A在B中燃烧的现象是
(3)D+E→B的反应中,n(被氧化的物质):n(被还原的物质)=
(4)G+J→M的离子方程式是
(5)Y受热分解的化学方程式是
查看习题详情和答案>>

请回答下列问题:
(1)B中所含元素位于周期表中
三
三
周期ⅤⅡA
ⅤⅡA
族,请写出C的电子式

(2)A在B中燃烧的现象是
气体安静燃烧,火焰呈苍白色,并有白雾产生
气体安静燃烧,火焰呈苍白色,并有白雾产生
.(3)D+E→B的反应中,n(被氧化的物质):n(被还原的物质)=
2:1
2:1
.(4)G+J→M的离子方程式是
3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓
3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓
.写出C+F→G的离子方程式是2OH-+2Al+2H2O=2AlO2-+3H2↑
2OH-+2Al+2H2O=2AlO2-+3H2↑
.(5)Y受热分解的化学方程式是
4Fe(NO3)3=2Fe2O3+12NO2↑+3O2↑
4Fe(NO3)3=2Fe2O3+12NO2↑+3O2↑
.